题目内容
【题目】下列示意图与对应的反应情况符合的是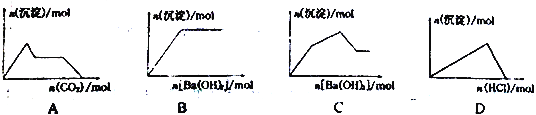
A. 向含0.01molKOH和0.01mo1Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向NaAlO2溶液中逐滴加入盐酸至过量
【答案】B
【解析】A、可以理解为通入的CO2先与Ca(OH)2反应生成CaCO3沉淀,然后是与KOH反应沉淀的量保持不变,最后是与CaCO3反应使沉淀溶解,选项A错误;B、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量,反应一开始就产生硫酸钡沉淀直至硫酸根离子消耗完沉淀不再增加,选项B正确;C、假设溶液中含1 mol KAl(SO4)2,加入1.5 mol的Ba(OH)2时生成1.5mol BaSO4和1 mol Al(OH)3沉淀的物质的量最大为2.5 mol,再加入0.5 mol Ba(OH)2,生成0.5 mol BaSO4,溶解1 mol Al(OH)3,故沉淀的总物质的量先增多后减少再不变,选项C错误;D、向NaAlO2溶液中逐滴加入盐酸至过量依次发生的反应是NaAlO2+HCl+H2O=NaCl+Al(OH)3、Al(OH)3+3HCl=AlCl3+3H2O,生成沉淀消耗的HCl和溶解沉淀消耗的HCl应为1: 3,选项D错误。答案选B。

练习册系列答案
相关题目