题目内容
【题目】某溶液中发生反应:A2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( ) 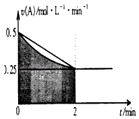
A.0﹣2min,速率不断减少的主要原因是A的浓度减少
B.反应开始前2min,C的浓度增加量等于A的浓度减少量
C.至2min时,A的物质的量减小值可能是0.5mol
D.至2min时,c(B)介于1molL﹣1 至1.5molL﹣1 之间
【答案】C
【解析】解:根据图象可知,阴影部分的面积△c(A)的范围为:0.25 molL﹣1min﹣1×2min=0.5molL﹣1<△c(A)<0.25 molL﹣1min﹣1×2min+ ![]() ×0.25 molL﹣1min﹣1×2min=0.75molL﹣1;A.浓度越小化学反应速率越小,随着反应的进行,A浓度逐渐减小,则化学反应速率逐渐减小,故A正确;
×0.25 molL﹣1min﹣1×2min=0.75molL﹣1;A.浓度越小化学反应速率越小,随着反应的进行,A浓度逐渐减小,则化学反应速率逐渐减小,故A正确;
B.同一可逆反应中同一段时间内各物质的浓度变化量之比等于其计量数之比,A、C的计量数相等,则反应开始前2min,二者的浓度变化量之比等于其计量数之比为1:1,所以C的浓度增加量等于A的浓度减少量,故B正确;
C.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值,不是物质的量的减小值,故C错误;
D.物质的量变化与化学计量数成正比,则2min时,B的物质的量浓度c(B)介于:0.5mol/L×2=1mol/L~0.75mol/L×2=1.5mol/L之间,故D正确;
故选C.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案