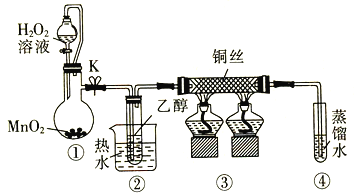
题目内容
【题目】工业上主要采用甲醇与CO的羰基化反应来制备乙酸,发生反应如下:CH3OH(g)+CO(g)=CH3COOH(l)。在恒压密闭容器中通入0.20mol的CH3OH(g)和0.22mol的CO,测得甲醇的转化率随温度变化如图所示。已知在T2温度下,达到平衡时容器的体积为2L。下列说法正确的是( )
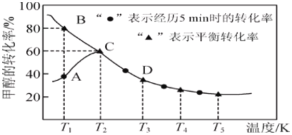
A.该反应的ΔH>0
B.缩小容器容积,既能加快反应速率,又能提高乙酸的产率
C.温度为T1时,该反应的正反应速率:B点大于A点
D.温度为T2时,向上述已达到平衡的恒压容器中,再通入0.12molCH3OH和0.06molCO的混合气体,平衡不移动
【答案】BD
【解析】
A. 根据图像,随着温度升高甲醇的平衡转化率降低,平衡向逆反应方向进行,根据勒夏特列原理,该反应的正反应为放热反应,即△H<0,故A错误;
B. 缩小容器的体积,相当于增大体系压强,反应速率加快,且平衡正向移动,乙酸的产率提高,故B说法正确;
C. 根据图像,T1温度下未达到平衡,反应向正方向进行,该反应的正反应速率:A点大于B点,故C说法错误;
D. T2下,甲醇的转化率为60%,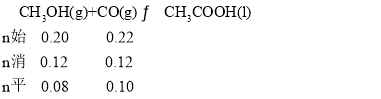 ,达到平衡,此时容器的体积为2L,c(CH3OH)=0.04mol·L-1,c(CO)=0.05mol·L-1,化学平衡常数K=
,达到平衡,此时容器的体积为2L,c(CH3OH)=0.04mol·L-1,c(CO)=0.05mol·L-1,化学平衡常数K=![]() =500,再充入0.12molCH3OH和0.06molCO,此时气体总物质的量与原平衡时气体总物质的量相等,即容器的体积为4L,此时c(CH3OH)=
=500,再充入0.12molCH3OH和0.06molCO,此时气体总物质的量与原平衡时气体总物质的量相等,即容器的体积为4L,此时c(CH3OH)=![]() =0.05mol·L-1,c(CO)=
=0.05mol·L-1,c(CO)=![]() =0.04mol·L-1,Qc=
=0.04mol·L-1,Qc=![]() =K,说明平衡不移动,故D说法正确;
=K,说明平衡不移动,故D说法正确;
答案:BD。

【题目】关于室温下下列溶液的说法不正确的是( )
编号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 盐酸 | 醋酸溶液 |
pH | 11 | 11 | 3 | 3 |
A. 水的电离程度:①=②=③=④
B. 分别加水稀释10倍,溶液的pH:①>②>③>④
C. ①③两溶液等体积混合:c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. V1 L溶液②与V2 L溶液③混合,若V1∶V2=9∶11,则混合溶液pH=4(忽略溶液体积变化)