题目内容
【题目】四氢噻吩(![]() )是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是( )
)是家用天然气中人工添加的气味添加剂具有相当程度的臭味。下列关于该化合物的说法正确的是( )
A.不能在O2中燃烧
B.![]() 所有原子可能共平面
所有原子可能共平面
C.![]() 与Br2的加成产物只有一种
与Br2的加成产物只有一种
D.生成1molC4H9SH至少需要2molH2
【答案】B
【解析】
由结构可知,含碳碳双键,且含C、H、S元素,结合双键为平面结构及烯烃的性质来解答。
A.家用天然气中可人工添加,能在O2中燃烧,故A错误;
B.含双键为平面结构,所有原子可能共平面,故B正确;
C.含2个双键,若1:1加成,可发生1,2加成或1,4加成,与溴的加成产物有2种,若1:2加成,则两个双键都变为单键,有1种加成产物,所以共有3种加成产物,故C错误;
D.![]() 含有2个双键,消耗2molH2,会生成1mol
含有2个双键,消耗2molH2,会生成1mol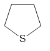 ,故D错误;
,故D错误;
故答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.(1)同学用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液测定计算中和反应的反应热。回答下列向题:
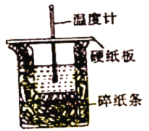
从实验装置上看,图中缺少的一种玻璃用品是_______。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将___填“偏大”、“偏小”或“无影响”)。已知稀盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73kJ的热量,则表示该反应中和热的热化学方程式为________。
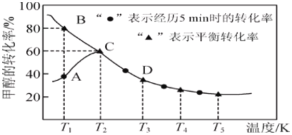
(2)乙同学用另一装置将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。回答下列问题:
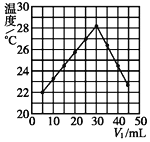
做该实验时,环境温度__(填“高于”、“低于”或“等于”)22℃。根据图计算该NaOH溶液的浓度约是__mol·L-1。
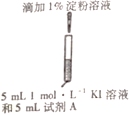
II.某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
② | 20℃ | 1min左右出现蓝色 | ||
③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 | |
④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究量度对反应速率的影响,实验②中试剂A应为___。
(2)写出实验③中I-反应的离子方程式_____。
(3)对比实验②③④,可以得出的结论是_________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2-。
ii.pH>9.28时,I2-发生歧化反应:3I2-+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示。
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的pH | 8 | 9 | 10 | 11 |
放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
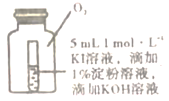
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是__(填序号)。
A 发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B 发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C 生了氧化反应,但没有发生歧化反应
D 生了歧化反应,但没有发生氧化反应
【题目】氯化亚铜(![]() )在化工、印染、电镀等行业应用广泛。
)在化工、印染、电镀等行业应用广泛。![]() 微溶于水,不溶于醇和稀酸,可溶于
微溶于水,不溶于醇和稀酸,可溶于![]() 浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量
浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量![]() )为原料,采用硝酸铵氧化分解技术生产
)为原料,采用硝酸铵氧化分解技术生产![]() 的工艺过程如图。回答下列问题:
的工艺过程如图。回答下列问题:

(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式______________。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________,滤液中可循环利用的物质是__________。
(3)步骤⑤中,用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为![]() 被氧化为
被氧化为![]() 的化学方程式为______________________。
的化学方程式为______________________。
(4)用![]() 溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品
溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品![]() ,将其置于过量的
,将其置于过量的![]() 溶液中,待样品完全溶解后,加入适量稀硫酸配成
溶液中,待样品完全溶解后,加入适量稀硫酸配成![]() 溶液,取溶液
溶液,取溶液![]() 用
用![]() 溶液进行滴定,反应中
溶液进行滴定,反应中![]() 被还原成
被还原成![]() ,相关数据记录如表所示:该样品中
,相关数据记录如表所示:该样品中![]() 的质量分数__________________。
的质量分数__________________。
实验编号 | 1 | 2 | 3 |
消耗 | 14.98 | 16.03 | 15.02 |
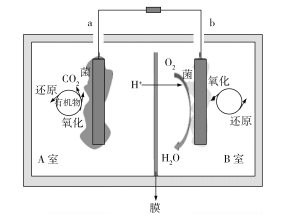
(5)制造印刷电路板产生的废液中含大量![]() 等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到
等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到![]() ,电解时阴极的电极反应式为___________,生成
,电解时阴极的电极反应式为___________,生成![]() 的离子方程式为________________________________。
的离子方程式为________________________________。