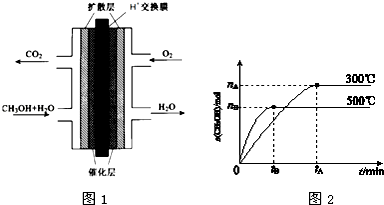
��Ŀ����
1��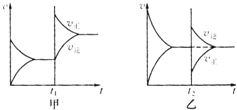 ��һ�������£��з�ӦxA+yB?zC��
��һ�������£��з�ӦxA+yB?zC������A��B��C��Ϊ���壬��2L���ܱ������У�����2mol A��1mol B��һ���¶��´ﵽƽ�⣮���ƽ����ѹǿΪ��Ӧǰ��$\frac{4}{5}$��ƽ��ʱCΪ0.6mol•L-1��BΪ0.2mol•L-1��
�Իش��������⣺
��1��ƽ��ʱB�����ʵ�����0.4mol��B��ת����=60%
��2��x��y��z=2��1��2�����¶���ƽ�ⳣ��=11.25
������ӦxA+yB?zC�Ѵﵽƽ�⣮�ı���������������ʱ��ı仯��ͼ���ң��Իش��������⣺
��1��ͼ����t1ʱ�ı������������BC������ĸ��ţ���
A����A��B��Ϊ���壬����A��B
B����A��BΪ���壬CΪ���壬����ѹǿ
C��A��B��������һ�������壬�Ҽ��������
D�������¶�
E���������
��2����A��B��C��Ϊ���壬����x mol A��y mol B���ﵽƽ�������ͼ����t2ʱ�ı仯�����ʱ�����仯������Ϊ��д��һ��������ɣ�������C��Ũ�ȡ�ͬʱ�ּ�СA��B��Ũ�ȣ�
���� ��1����A��B��C��Ϊ���壬ƽ��ʱB�����ʵ���Ϊ0.2mol/L��2L=0.4mol�����ĵ�B�����ʵ���Ϊ1mol-0.4mol=0.6mol��ת����=$\frac{���ʵ����仯��}{��ʼ���ʵ���}$��100%��
��2�����º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱ������������ʵ���Ϊ��2+1��mol��$\frac{4}{5}$=2.4mol��ƽ��ʱCΪ0.6mol/L��2L=1.2mol��ƽ��ʱAΪ2.4mol-1.2mol-0.4mol=0.8mol�������ĵ�AΪ2mol-0.8mol=1.2mol����x��y��z=1.2��0.6��1.2=2��1��2���ʷ�Ӧ����ʽΪ��2A+B?2C���ٸ���K=$\frac{{c}^{2}��C��}{{c}^{2}��A����c��B��}$����ƽ�ⳣ����
��1����ͼ��֪��t1ʱ����Ӧ���ʱ���淴Ӧ����û�䣬˵���������˷�Ӧ���Ũ�ȣ�
��2����ͼ�ҿ�֪��t2ʱ����Ӧ���ʱ�С���淴Ӧ���ʱ������Ӧ���ʼ�С�������������������Ũ�ȡ�ͬʱ�ּ�С��Ӧ���Ũ�ȣ�
��� �⣺��1����A��B��C��Ϊ���壬ƽ��ʱB�����ʵ���Ϊ0.2mol/L��2L=0.4mol�����ĵ�B�����ʵ���Ϊ1mol-0.4mol=0.6mol����B��ת����=$\frac{0.6mol}{1mol}$��100%=60%��
�ʴ�Ϊ��0.4mol��60%��
��2�����º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱ������������ʵ���Ϊ��2+1��mol��$\frac{4}{5}$=2.4mol��ƽ��ʱCΪ0.6mol/L��2L=1.2mol��ƽ��ʱAΪ2.4mol-1.2mol-0.4mol=0.8mol�������ĵ�AΪ2mol-0.8mol=1.2mol����x��y��z=1.2��0.6��1.2=2��1��2����Ӧ����ʽΪ��2A+B?2C��ƽ��ʱA��Ũ��Ϊ$\frac{0.8mol}{2L}$=0.4mol/L����K=$\frac{{c}^{2}��C��}{{c}^{2}��A����c��B��}$=$\frac{0��{6}^{2}}{0��{4}^{2}��0.2}$=11.25��
�ʴ�Ϊ��2��1��2��11.25��
��1����ͼ��֪��t1ʱ����Ӧ���ʱ���淴Ӧ����û�䣬˵���������˷�Ӧ���Ũ�ȣ�
A����A��B��Ϊ���壬����A��B���ı���������Ӧ���ʲ��䣬��A����
B����A��BΪ���壬CΪ���壬����ѹǿ��A��BΪ�������Է�Ӧ��Ũ������CΪ��������ѹǿ��������Ũ����Ӱ�죬��B��ȷ��
C��A��B��������һ�������壬�Ҽ�������壬�൱������Ӧ��Ũ�ȣ���C��ȷ��
D�������¶ȣ����淴Ӧ���ʶ����D����
E��������������淴Ӧ����ͬ�ȳ̶ȱ��E����
�ʴ𰸣�BC��
��2����ͼ�ҿ�֪��t2ʱ����Ӧ���ʱ�С���淴Ӧ���ʱ������Ӧ���ʼ�С�������������C��Ũ�ȡ�ͬʱ�ּ�СA��B��Ũ�ȣ�
�ʴ�Ϊ������C��Ũ�ȡ�ͬʱ�ּ�СA��B��Ũ�ȣ�
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ�ⳣ������ѧƽ��ͼ��ȣ�ͼ������йؼ�������ı�����˲�������淴Ӧ���ʱ仯����Ŀ�Ѷ��еȣ�

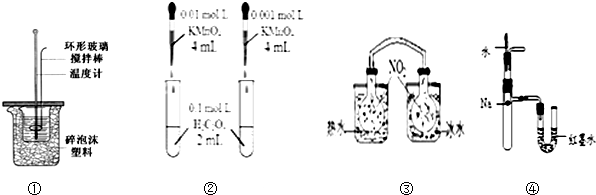
| A�� | װ�â����ڲⶨ�к���װ�� | |
| B�� | װ�â�������ɫ�����Ƚ�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� | |
| C�� | ��������������������ɫ�仯���жϷ�Ӧ2NO2��g��?N2O4��g��ƽ���ƶ��ķ��� | |
| D�� | װ�â�����U������Һ��ĸߵ��ж�Na��ˮ��Ӧ����ЧӦ |
| ����� | �ǵ���� | ������ | |
| A | H2SO4 | Cl2 | NaCl |
| B | NaOH | �ƾ� | N2 |
| C | CuSO4 | ˮ�� | CO2 |
| D | BaSO4 | ���� | KClO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | CH3CH2Cl | B�� | CO2 | C�� | Cl2 | D�� | NaNO3 |
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A�� | ��Ӧ��t1min�ڵ�ƽ������Ϊv��H2��=0.40/t1mol•L-1•min-1 | |
| B�� | ���������������䣬��ƽ����ϵ����ͨ��0.20molH2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת��������H2O�����������С | |
| C�� | ���������������䣬��ʼʱ�������г���0.60molCO��1.20 molH2O������ƽ��ʱ��n��CO2��=0.40 mol | |
| D�� | �¶�����800�棬������Ӧƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ |
| A�� | ������������� | |
| B�� | �������뱻��ԭ����Ԫ�ص�������Ϊ5��1 | |
| C�� | 3mol������������10Ħ������ת�� | |
| D�� | ����Ȳ����������ֲ��ǻ�ԭ�� |