题目内容
11.已知5KCl+KClO3+3H2SO4═3Cl2+3K2SO4+3H2O,下列说法不正确的是( )| A. | 氯酸钾是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | 3mol氯气生成是有10摩尔电子转移 | |
| D. | 硫酸既不是氧化剂又不是还原剂 |
分析 5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,以此来解答.
解答 解:5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,KCl中Cl元素由-1价升高到0,KClO3中Cl元素由+5价降低为0,
A.含元素化合价降低的物质为氧化剂,则KClO3是氧化剂,故A正确;
B.KCl为还原剂,被氧化,KClO3是氧化剂被还原,由反应可知被氧化与被还原的氯元素的质量比为5:1,故B正确;
C.由反应可知,3molCl2生成时有5mol电子转移,故C错误;
D.硫酸中各元素的化合价不变,则H2SO4既不是氧化剂又不是还原剂,故D正确.
故选C.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化及氧化还原反应中的基本概念即可解答,选项B为解答的易错点,题目难度不大

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列疾病与人体缺乏矿物质元素有关的是( )
| A. | 坏血病 | B. | 夜盲症 | C. | 骨质疏松 | D. | 糖尿病 |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,1mol丙烷共用电子对数为6NA | |
| B. | 1mol甲醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 0.1mol甲烷和0.1mol乙酸完全燃烧消耗的O2分子数都为0.2 NA |
6.硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见如图).下列说法正确的是
( )

( )

| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| C. | 漂白粉的有效成分为Ca(ClO)2 | |
| D. | 除去与水反应的两个反应,图示其余转化反应均为氧化还原反应 |
16.下列反应是氧化还原反应,且水既不做氧化剂,又不做还原剂的是( )
| A. | NaH+H2O═NaOH+H2↑ | B. | F2+2H2O═2O2↑+4HF | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | Mg2N2+6H2O═3Mg(OH)2+2NH3↑ |
3.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定含CO32- | |
| B. | 某无色溶液滴入酚酞试液显红色,该溶液呈碱性 | |
| C. | 某溶液中滴加BaCl2溶液生成不溶于稀硝酸的白色沉淀,该溶液可能含有SO42- | |
| D. | 验证烧碱溶液中是否含Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl- |
20.下面关于氢化物的叙述正确的是( )
| A. | 一个D2O分子所含的中子数为8 | B. | NH3的结构式为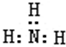 | ||
| C. | HCl的电子式为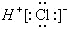 | D. | 热稳定性:H2S<HF |
1.关于金属性质和原因的描述不正确的是( )
| A. | 金属具有光泽是因为金属阳离子吸收了某些波长的可见光造成的 | |
| B. | 金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,在外电场的作用下自由电子定向移动便形成了电流,所以金属易导电 | |
| C. | 金属具有良好的导热性,是因为自由电子在受热后,加快了运动速率,自由电子通过与金属离子发生碰撞,传递了能量 | |
| D. | 金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破坏金属键 |
 在一定条件下,有反应xA+yB?zC.
在一定条件下,有反应xA+yB?zC.