题目内容
8.已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子.Y元 素的原子最外层电子数比内层电子数少3个.Z元素核外有3个电子层,最外层有3个电子.W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%.(1)X单质在空气中加热生成的化合物所含化学键的类型为离子键、共价键.
(2)X、Z的最高价氧化物对应水化物相互反应的离子方程式OH-+Al(OH)3═AlO2-+2H2O.
(3)W的常见低价氧化物与Y单质的水溶液反应的化学方程式SO2+Cl2+2H2O═H2SO4+2HCl.
(4)Y与Z形成化合物的化学式是AlCl3.实验测得当此化合物处于固态和熔融状态时不导电,溶于水能导电.由此判断该化合物是共价化合物 (填“离子”或“共价”).
分析 X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子,则M层电子数是1,所以X是Na元素;Y元素的原子最外层电子数比内层电子数少3个,最外层电子数不超过8个,所以内层电子数是10,最外层电子数为7,则Y是Cl元素;Z元素核外有3个电子层,最外层有3个电子,则Z是Al元素;W元素最高化合价是最低化合价绝对值的3倍,最外层电子数为6,W位于第VIA族,它的最高价氧化物可以表示为WO3,WO3中W元素的质量分数为40%,则W相对原子质量$\frac{48}{1-40%}$-48=32,故W是S元素.
解答 解:X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子,则M层电子数是1,所以X是Na元素;Y元素的原子最外层电子数比内层电子数少3个,最外层电子数不超过8个,所以内层电子数是10,最外层电子数为7,则Y是Cl元素;Z元素核外有3个电子层,最外层有3个电子,则Z是Al元素;W元素最高化合价是最低化合价绝对值的3倍,最外层电子数为6,W位于第VIA族,它的最高价氧化物可以表示为WO3,WO3中W元素的质量分数为40%,则W相对原子质量$\frac{48}{1-40%}$-48=32,故W是S元素.
(1)X单质在空气中加热生成的化合物为Na2O2,所含化学键的类型为:离子键、共价键,故答案为:离子键;共价键;
(2)X、Z的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应离子方程式为:OH-+Al(OH)3═AlO2-+2H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O;
(3)W的常见低价氧化物为SO2,与氯气的水溶液反应的化学方程式:SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O═H2SO4+2HCl;
(4)Y与Z形成化合物的化学式是AlCl3.实验测得当此化合物处于固态和熔融状态时不导电,溶于水能导电.由此判断该化合物是共价化合物,
故答案为:AlCl3;共价.
点评 本题考查结构性质位置关系应用,正确推断元素是解本题关键,注意氯化铝是共价化合物.

| A. | 钠 | B. | 铁 | C. | 银 | D. | 金 |
| A. | Ba2+ Cl- Na+ SO42- | B. | Ag+ NO3- K+ CO32- | ||
| C. | Cu2+ Cl- Ag+ OH- | D. | Na+ OH- K+ SO42- |
| A. | H2SO4 Na2CO3 Ca(OH)2 | B. | HCl NaOH K2CO3 | ||
| C. | H2CO3 C2H5OH Na2SO4 | D. | Ba(OH)2 H3PO4 KOH |
| A. | 15 | B. | 14 | C. | 13 | D. | 不能确定 |
| A. | 分离碘水中的碘--升华 | |
| B. | 分离白酒中的酒精和水--分液 | |
| C. | 除去海盐中的硫酸盐--溶解后加硝酸钡 | |
| D. | 分离海水中的水--蒸馏 |
| A. | 铁 | B. | 铝 | C. | 铜 | D. | 钠 |
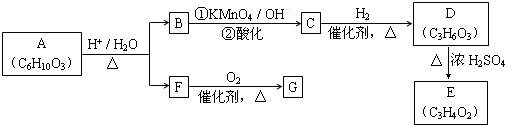
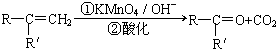 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)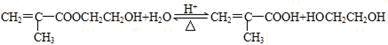 ;
;