题目内容
11.在500mL的密闭容器中装入1.5mol H2,0.5mol N2和0.05mol NH3.若该反应的反应速率 V(H2)=0.3mol/(L•min)时,求3分钟末时NH3的浓度?分析 氢气的反应速率v(H2)=0.3mol•L-1•min-1,依据反应速率之比等于化学方程式计量数之比计算氨气的反应速率,计算反应中物质变化的物质的量得到3min末物质物质的量,结合浓度概念计算c=$\frac{n}{V}$得到.
解答 解:N2+3H2=2NH3,由于V(H2)=0.3mol/(L•min),根据反应速率之比等于化学方程式计量数之比,v(NH3)=$\frac{2}{3}$v(H2)=$\frac{2}{3}$×0.3mol•L-1•min-1=0.2mol/(L•min),反应生成氨气的物质的量=0.2mol•L-1min-1×0.5L×3min=0.3mol,3min末的氨气物质的量=0.3mol+0.05mol=0.35mol,则c(NH3)=$\frac{0.35mol}{0.5L}$=0.7mol/L,
答:3分钟末时NH3的物质的量浓度为0.7mol/L.
点评 本题考查了化学平衡计算,反应速率概念的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列叙述中,正确的是( )
| A. | 可将试管、蒸发皿、坩埚直接置于酒精灯火焰上加热 | |
| B. | 将二氧化硫通入到紫色石蕊试液中,试液先变红后褪色 | |
| C. | 用托盘天平称量氢氧化钠固体时,应将固体放在称量纸上 | |
| D. | 容量瓶在使用前用蒸馏水润洗,会影响所配制溶液的浓度 |
2.填写下列表格:
| 物质 | 指定的微粒/个 | 质量(m)g | 物质的量(n)mol | 摩尔质量(M)g/mol |
| He | 0.2 | |||
| S | 1.204×1023 | |||
| Na+ | 11.5 | |||
| C6H12O6 | 0.25 |
19.下列各组离子中,能在溶液中大量共存的是( )
| A. | Ba2+ Cl- Na+ SO42- | B. | Ag+ NO3- K+ CO32- | ||
| C. | Cu2+ Cl- Ag+ OH- | D. | Na+ OH- K+ SO42- |
16.将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
| A. | H2SO4 Na2CO3 Ca(OH)2 | B. | HCl NaOH K2CO3 | ||
| C. | H2CO3 C2H5OH Na2SO4 | D. | Ba(OH)2 H3PO4 KOH |
20.室温下,向VmLpH=a的盐酸中滴加pH=b的NaOH溶液10VmL,所得溶液中c(Cl-)=c(Na+)则此时(a+b)的值为( )
| A. | 15 | B. | 14 | C. | 13 | D. | 不能确定 |
3.氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1实验装置.请回答:
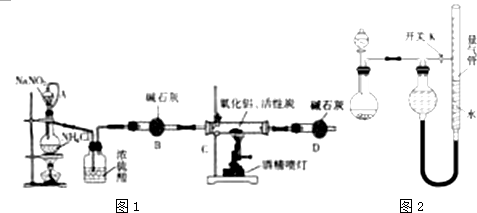
(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出样品中AlN的质量分数为61.5%.

(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 氮化铝样品质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 350.0mL | 13.7mL |
| ② | 1.0g | 350.0mL | 25.0mL |
| ③ | 1.0g | 350.0mL | 14.3mL |