题目内容
18.将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,均有氯化银产生,它们的离子反应方程式是Ag++Cl-=AgCl↓,说明离子反应方程式不仅表示一 定物质间的具体的化学反应,而且表示了同一类型离子反应.分析 硝酸银电离产生银离子,HCl、NaCl、KCl电离都能产生氯离子,银离子与氯离子反应生成氯化银,离子反应不仅可以表示某一个具体的化学反应,而且可以表示同一类反应,据此解答.
解答 解:将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,硝酸银电离产生银离子,HCl、NaCl、KCl电离都能产生氯离子,银离子与氯离子反应生成氯化银,离子方程式:Ag++Cl-=AgCl↓,离子方程式的意义:不仅可以表示某一个具体的化学反应,而且可以表示同一类反应,
故答案为:氯化银;Ag++Cl-=AgCl↓;具体的化学反应;表示同一类反应.
点评 本题考查了离子方程式的书写及意义,明确离子反应条件及离子方程式书写方法即可解答,题目难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 按系统命名法 的全称为3-乙基-1-丁烯 的全称为3-乙基-1-丁烯 | |
| B. | 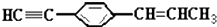 最多有7个碳原子在一条直线上 最多有7个碳原子在一条直线上 | |
| C. | 由2-氯丙烷制取1,2-丙二醇CH2CH(OH)CH2OH时,经过的反应消去→加成→取代 | |
| D. | 蛋白质和油脂都属于高分子化合物,一定条件下能水解 |
13.下列水溶液中的各组离子能大量共存的是( )
| A. | Na+、Ba2+、Cl?、SO42- | B. | Ca2+、HCO3?、C1?、K+ | ||
| C. | HCO3?、K+、I?、H+ | D. | H+、Cl?、Na+、CO32 |
7.在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
| A. | 若滤出的固体只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+ | |
| B. | 若滤出的固体只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+ | |
| C. | 若滤出的固体只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+ | |
| D. | 若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+ |
10.蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名.蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成.工业上由蛇纹石制取碱式碳酸镁产品的流程如下:
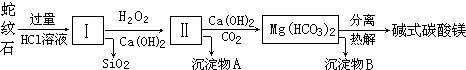
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是Fe3+、Fe2+.
(2)向Ⅰ中加入H2O2的作用是将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,有关离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O,加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
若pH>8可能导致的后果Al(OH)3溶解、Mg2+沉淀.
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入NaOH溶液,然后过滤、洗涤、(干燥)灼烧(填写实验操作名称),即可获得红色颜料,实现废物的综合利用.
(4)若产品的化学式用aMgCO3•bMg(OH)2•cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a=3,b=1,c=3.

(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是Fe3+、Fe2+.
(2)向Ⅰ中加入H2O2的作用是将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,有关离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O,加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入NaOH溶液,然后过滤、洗涤、(干燥)灼烧(填写实验操作名称),即可获得红色颜料,实现废物的综合利用.
(4)若产品的化学式用aMgCO3•bMg(OH)2•cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a=3,b=1,c=3.