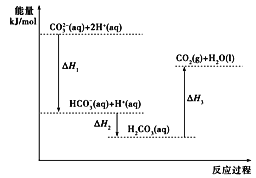
题目内容
【题目】科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是
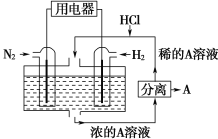
A. 通入N2的电极发生的电极反应式为:N2+6e-+8H+=2NH4+
B. 反应过程中溶液的pH会变大,故需要加入盐酸
C. 该电池外电路电流从通入H2的电极流向通入N2的电极
D. 通入H2的电极为负极,A为NH4Cl
【答案】C
【解析】
原电池中负极发生失去电子的氧化反应,正极发生得到电子的还原反应,据此分析解答。
A.正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,故A正确;
B.放电过程中,负极电极反应为H2-2e-=2H+,正极电极反应N2+8H++6e-=2NH4+,总反应式为N2+3H2+2H+=2NH4+,消耗氢离子,电解质溶液pH升高,故需要加入盐酸,故B正确;
C.通入N2的电极为正极,通入H2的电极为负极,因此电流由通入N2的正极流向通入H2的负极,故C错误;
D.放电过程中,负极电极反应为H2-2e-=2H+,正极电极反应N2+8H++6e-=2NH4+,总反应式为N2+3H2+2H+=2NH4+,则通入H2的电极为负极,A为NH4Cl,故D正确;
答案选C。

【题目】经测定乙醇的分子式是C2H6O,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ.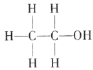 Ⅱ.
Ⅱ.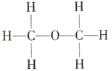
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。
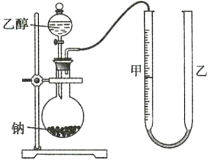
(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___(填“Ⅰ”或“Ⅱ”),原因是___。
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
(3)学生丙不想通过称取乙醇的质量来确定乙醇的物质的量,那么他还需要知道的数据是___。