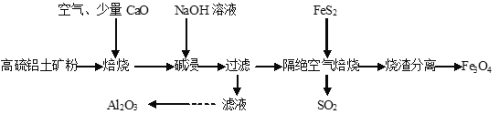
题目内容
【题目】下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
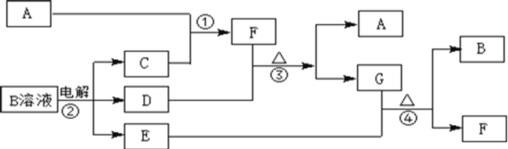
(1)写出化学式A_______,D_________,F_______;
(2)鉴定G中阳离子的实验方法和现象_____________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式_________、_______。
(4)常温下,电解B溶液制得pH = 12的烧碱溶液1000mL则反应中转移的电子数目为________。
【答案】N2 Cl2 NH3 取少量D的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色 2OH-+Cl2=ClO-+Cl-+H2O 8NH3+3Cl2=N2+6NH4Cl 0.01NA
【解析】
A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂,判断F为NH3;B电解生成CDE,可以初步推断是电解氯化钠溶液的产物为H2、Cl2、NaOH,所以C为H2,A为N2,D+F(NH3)=A(N2)+G,能发生反应的只能是D为Cl2,推断G为NH4Cl,G(NH4Cl)+E(NaOH)=B(NaCl)+F(NH3),符合转化关系;
(1)由以上分析可知A为N2,D为Cl2,F为NH3,故答案为:N2;Cl2;NH3;
(2)G为NH4Cl,阳离子为![]() ,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;故答案为:取少量G的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;故答案为:取少量G的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色;
(3)D单质和E溶液反应是氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,则离子反应为2OH-+Cl2=ClO-+Cl-+H2O,故答案为:2OH-+Cl2=ClO-+Cl-+H2O;
(4) B是NaCl,常温下,pH = 12的烧碱溶液1000mL,![]() ,电解NaCl溶液的化学方程式:
,电解NaCl溶液的化学方程式:![]() ,由转移电子数与产物氢氧化钠的关系式可知:
,由转移电子数与产物氢氧化钠的关系式可知: ,反应中转移的电子数目为0.01 NA;故答案为0.01 NA。
,反应中转移的电子数目为0.01 NA;故答案为0.01 NA。

 阶梯计算系列答案
阶梯计算系列答案【题目】一定温度下,在3个体积均为l.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)分别达到平衡。下列说法正确的是
CH3OH(g)分别达到平衡。下列说法正确的是
容器 | 温度(K) | 起始浓度(mol/L) | CH3OH平衡浓度(mol/L) | ||
H2 | CO | CH3OH | |||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | X |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应是吸热反应
B. X=0.16
C. 平衡时,容器②中H2的体积分数比容器①的大
D. 400K时若再向容器①中充入0.10molH2、0.10molCO和0.10molCH3OH,则平衡将向正反应方向移动