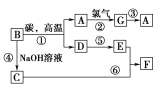
题目内容
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素在元素周期表中的位置为____________________
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 __________________
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4,反应生成N2和水蒸气。
已知①N2(g)=N2O4(l) △H1=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534.2kJ·mol-1
肼和N2O4反应的热化学方程式为___________________________
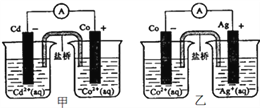
(4)“长征“火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,既能在短时间内产生巨大能量,产物又不污染空气( 产物都是空气成分)。将此原理设计为原电池,如下图所示,据此回答问题:

①B为___________极,从d口排出的气体是____________ 。
②A极发生的电极反应式:____________________。
【答案】 第二周期VA族 2NH3+NaCIO=N2H4+NaCl+H2O 2N2H4(I)+N2O4(I)=3N2(g)+4H2O(g) △H=-1048.9)kJ mol-1 正 N2 C2H8N2-16e-+4H2O=2C02+N2+16H+
【解析】(1)氮是7号元素,在元素周期表中的位置为第二周期VA族;(2)NH3与NaClO反应可得到肼(N2H4)同时生成氯化钠和水,反应的化学方程式为:2NH3+NaCIO=N2H4+NaCl+H2O;
(3)已知①N2(g)+202(g)= N2O4 (l) △H1=- 19.5kJ .mol-1
②N2H4(l)+ O2(g)= N2(g)+ 2H2O(g) △H2=-534.2kJ.mol-1
根据盖斯定律,由②×2-①得反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=△H2×2-△H1=-1048.9kJ.mol-1;
(4)①电子流出的电极为负极,电子流入的电极为正极,所以B为正极;根据题目所给信息,产物都是空气成分,则四氧化二氮得电子生成氮气,所以从d口排除的气体是N2;②四氧化二氮作为氧化剂,在反应中得电子,应通入正极,即从b口通入,则a口通入偏二甲肼(C2H8N2)在A极上失电子产生二氧化碳和氮气,反应的电极反应式为:C2H8N2-16e-+4H2O=2C02+N2+16H+。

【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 从食盐水中提取NaCl固体 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. A B. B C. C D. D
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。