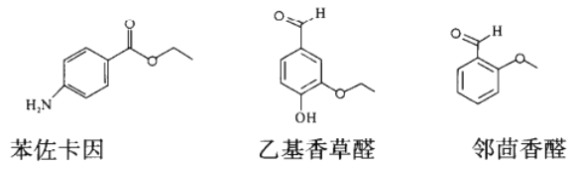
题目内容
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
【答案】 ab MnO2+FeS2+2H2SO4![]() MnSO4+FeSO4+2S+2H2O 使Fe3+、Al3+完全沉淀 Cu(OH)2 温度过低反应太慢,过高,NH4HCO3会分解 2HCO3+Mn2+
MnSO4+FeSO4+2S+2H2O 使Fe3+、Al3+完全沉淀 Cu(OH)2 温度过低反应太慢,过高,NH4HCO3会分解 2HCO3+Mn2+![]() MnCO3↓+H2O+CO2↑ 取最后一次洗涤液,加入盐酸酸化的BaCl2溶液,若无沉淀,则已洗净
MnCO3↓+H2O+CO2↑ 取最后一次洗涤液,加入盐酸酸化的BaCl2溶液,若无沉淀,则已洗净
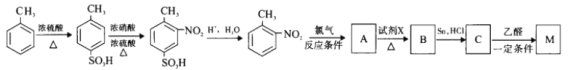
【解析】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。根据流程图,硫酸与软锰矿和黄铁矿作用,二氧化锰与FeS2在酸性溶液中发生氧化还原反应,生成硫酸锰和硫沉淀,同时生成少量的硫酸铝、硫酸亚铁等,二氧化硅不反应,和硫一起形成滤渣Ⅰ;再加入二氧化锰,二氧化锰可将亚铁离子氧化为铁离子;加氨水调节溶液的pH=5.4~5.8把铁离子和铝离子转化为沉淀除去,则滤渣II为Fe(OH)3、Al(OH)3;继续加氨水调节溶液的pH=6~8把铜离子转化为沉淀除去,则滤渣Ⅲ为Cu(OH)2;加碳酸氢铵50℃碳化得碳酸锰、二氧化碳和硫酸铵等。
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸增大硫酸浓度或粉粹矿石或延长浸泡时间,故选ab;
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,说明溶液中没有铁离子,则浸取时发生的主要反应的化学方程式为MnO2+FeS2+2H2SO4=MnSO4+FeSO4+2S+2H2O,故答案为:MnO2+FeS2+2H2SO4=MnSO4+FeSO4+2S+2H2O;
(3)根据上述分析,调节pH为5.4~5.8的目的是使Fe3+、Al3+完全沉淀,故答案为:使Fe3+、Al3+完全沉淀;
(4)滤渣3的主要成分为Cu(OH)2,故答案为:Cu(OH)2;
(5)温度过低反应太慢,过高,NH4HCO3会分解,因此采用50℃碳化,该过程发生反应的离子方程式为2HCO3+Mn2+=MnCO3↓+H2O+CO2↑,故答案为:温度过低反应太慢,过高,NH4HCO3会分解;2HCO3+Mn2+=MnCO3↓+H2O+CO2↑;
(6)根据流程图,碳酸锰上吸附有少量硫酸铵,检验碳酸锰产品是否洗净只需要检验硫酸根离子即可,故答案为:取最后一次洗涤液,加入盐酸酸化的BaCl2溶液,若无沉淀,则已洗净。

【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
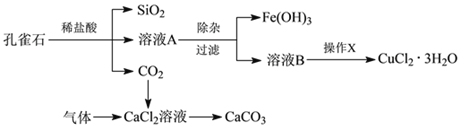
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。