题目内容
19.能够证明乙醇分子(C2H6O)组成的最充分的理由是( )| A. | 23g乙醇与足量的金属钠反应,可以放出0.25mol氢气 | |
| B. | 1mol乙醇充分燃烧生成2mol CO2和3mol H2O,消耗3mol O2 | |
| C. | 乙醇的沸点高于乙烷 | |
| D. | 1mol乙醇氧化后生成1mol乙醛 |
分析 能说明乙醇的分子式是C2H6OH,说明其含有2个C原子、6个H原子和1个O原子即可,不能根据物理性质判断,以此解答.
解答 解:A、23g乙醇(即0.5mol)与足量钠反应只产生0.25mol氢气,则1mol乙醇能够与足量钠反应生成0.5mol氢气,说明乙醇分子中含有1个羟基,从而证明乙醇分子结构简式为C2H5OH,而不是CH3OCH3,故A错误;
B、1mol乙醇充分燃烧生成2mol CO2和3mol H2O,消耗3mol O2,依据元素守恒,说明乙醇分子中含有2个C原子、6个H原子和一个O原子,故B正确;
C、乙醇分子组成与沸点无关,故C错误;
D、1mol乙醇氧化后生成1mol乙醛与分子组成无关,故D错误;故选B.
点评 本题考查了确定有机物结构简式的方法,题目难度不大,注意掌握常见有机物结构与性质,明确确定有机物分子式、结构式的方法.

练习册系列答案
相关题目
4.短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,金属铝能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| X | Y | |
| W | Q |
| A. | Y的最高化合价为+6 | B. | 简单离子的半径:W>Q>Y>X | ||
| C. | 氢化物的稳定性:W>Y | D. | 最高价氧化物的水化物的酸性:W<Q |
11.下列有关实验仪器的使用及实验操作正确的是( )
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 配制0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O晶体 |
8.分类是学习和研究化学的一种重要方法.下列分类合理的是( )
| A. | HCl和H2SO4都属于酸 | B. | K2CO3和K2O都属于盐 | ||
| C. | NaOH和Na2CO3都属于碱 | D. | H2O和O2都属于氧化物 |
9.药物使数以万计的人摆脱疾病困扰,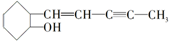 是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )
是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )
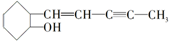 是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )
是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )| A. | 该有机物的分子式为C11H16O | |
| B. | 该有机物可以使溴水褪色 | |
| C. | 该有机物易溶于水 | |
| D. | 光照,该有机物可以与氯气发生取代反应 |
 ;
;
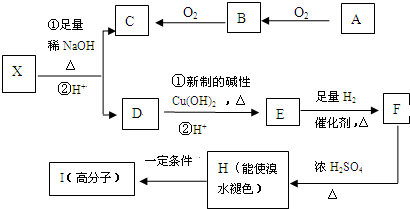
 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示转化关系回答:
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.根据图示转化关系回答: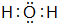 .
.

 (R、R′代表烃基)
(R、R′代表烃基)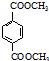 有多种同分异构体,同时满足下列条件的同分异构体有8种.
有多种同分异构体,同时满足下列条件的同分异构体有8种. .
.