题目内容
4.下列表示物质变化的化学用语正确的是( )| A. | 已知在298K时下述反应的有关数据:C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H1=-110.5 kJ•mol-1C(s)+O2(g)═CO2(g)△H2=-393.5 kJ•mol-1,则C(s)+CO2(g)═2CO(g)△H=-172.5 kJ•mol-1 | |
| B. | KI溶液中滴加过量氯水发生反应的离子方程式为3Cl2+I-+3H2O═6H++IO3-+6Cl- | |
| C. | 等物质的量的NH4HCO3与Ba(OH)2 溶液混合反应的离子方程式为Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| D. | 用铜作电极电解硫酸溶液:2H2O$\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
分析 A.①C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H1=-110.5 kJ•mol-1,②C(s)+O2(g)═CO2(g)△H2=-393.5 kJ•mol-1,由盖斯定律可知,①×2-②得到C(s)+CO2(g)═2CO(g);
B.滴加过量氯水,发生氧化还原反应生成碘酸钾和盐酸;
C.等物质的量反应时,反应生成碳酸钡、水、一水合氨;
D.用铜作电极,阳极Cu失去电子.
解答 解:A.①C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H1=-110.5 kJ•mol-1,②C(s)+O2(g)═CO2(g)△H2=-393.5 kJ•mol-1,由盖斯定律可知,①×2-②得到C(s)+CO2(g)═2CO(g),则△H=(-110.5 kJ•mol-1)×2-(-393.5 kJ•mol-1)=+172.5 kJ•mol-1,故A错误;
B.KI溶液中滴加过量氯水发生氧化还原反应,其离子方程式为3Cl2+I-+3H2O═6H++IO3-+6Cl-,遵循电子、电荷守恒及原子守恒,故B正确;
C.等物质的量的NH4HCO3与Ba(OH)2 溶液混合反应的离子方程式为NH4++Ba2++HCO3-+2OH-═BaCO3↓+H2O+NH3.H2O,故C错误;
D.用铜作电极电解硫酸溶液的离子反应为Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cu(OH)2↓,故D错误;
故选B.
点评 本题考查较综合,涉及离子反应方程式书写,盖斯定律计算反应热、电解反应等,注重高频考点的考查,把握离子之间的反应及反应原理为解答的关键,综合性较强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.用下列实验装置进行的实验中,能达到相应实验目的是( )
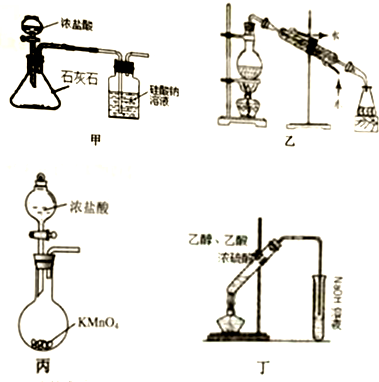

| A. | 装置甲:验证碳的非金属性比硅强 | |
| B. | 装置乙:石油分馏分别得到汽油、柴油、煤油 | |
| C. | 装置丙:实验室制取氯气的反应发生装置 | |
| D. | 装置丁:实验室制取乙酸乙酯 |
15.下列描述错误的是( )
| A. | 可以使用排水法收集氨气 | |
| B. | Na2O2既含有离子键,又含有非极性键 | |
| C. | 金属元素从游离态变为化合态一定被氧化 | |
| D. | Na2CO3饱和溶液中持续通入CO2气体有固体析出 |
12.氮化碳是化工行业已合成的一种硬度比金刚石还大的晶体,已知在此化合物中各元素均处于其最高或最低价态,下列有关“氮化碳”的叙述正确的是( )
| A. | 氮化碳的化学式为C4N3 | |
| B. | 氮化碳的晶体类型为离子晶体 | |
| C. | 构成氮化碳晶体的微粒是碳原子和氮原子,且构成空间网状结构 | |
| D. | 氮化碳晶体中存在的微粒间的作用力有共价键和分子间作用力 |
19.下列各组物质中分子、离子或晶体的空间结构完全不同的是( )
| A. | NH3和H3O+ | B. | NH4+和CH4 | C. | CO2和SiO2 | D. | 金刚石和晶体硅 |
13.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 浓硫酸溅在皮肤上,使皮肤呈黄色是由于浓硫酸和蛋白质发生了颜色反应 |
14.向氯化钡溶液中通二氧化硫气体,未见沉淀出现,但若在此溶液中再加入少量的某种物质,立即出现白色沉淀,该物质不可能是( )
| A. | 氨水 | B. | 氢氧化钠 | C. | 酸性高锰酸钾 | D. | 盐酸 |
 .
.