题目内容
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)
2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)![]() CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
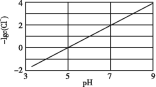
A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的ΔH=(a+2b)kJ/mol
CuCl(s)的ΔH=(a+2b)kJ/mol
【答案】C
【解析】
A.K只受温度的影响,pH增大,难溶电解质的溶度积常数Ksp(CuCl)不变,A错误;
B.根据图中信息:溶液的pH越大,氯离子的浓度越小,电解液中加入稀硫酸,不利于Cl-的去除,B错误;
C.反应达到平衡状态,增大c(Cu2+),K不变,所以c(Cl-)减小,C正确;
D.①Cu(s)+Cu2+(aq)![]() 2Cu+(aq) △H1=a kJ/mol,
2Cu+(aq) △H1=a kJ/mol,
②Cl-(aq)+ Cu+(aq)![]() CuCl(s) △H2=b kJ/mol
CuCl(s) △H2=b kJ/mol
①÷2+②可得到:.![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s),根据盖斯定律反应的△H=(0.5a+b)kJ/mol,D错误;
CuCl(s),根据盖斯定律反应的△H=(0.5a+b)kJ/mol,D错误;
故合理选项是C。

练习册系列答案
 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
【题目】下表所列各组物质中,能一步实现如图所示各步转化关系的是( )

选项 | X | Y | Z | W |
A | Fe3O4 | Fe | FeCl2 | FeCl3 |
B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
C | NH3 | NO | NO2 | HNO3 |
D | Si | SiO2 | H2SiO3 | Na2SiO3 |
A.AB.BC.CD.D