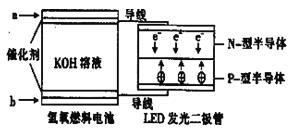
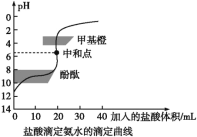
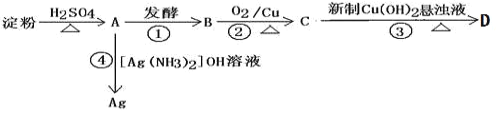
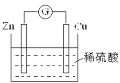
题目内容
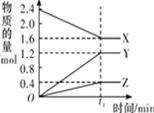
【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2 表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应生成NH3__________(填:吸收或放出多少)kJ 能量。但事实上,将 1molN2 和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
【答案】2X3Y+Z 0.6/t1 (mol.L-1.min-1) 放出92 该反应为可逆反应,充分反应的最终结果是达到最大限度时,转化率小于100%,因此放出的热量总是小于理论计算值 ABD
【解析】
(1)分析图像中X、Y、Z物质的量的变化值之比,据此写出该反应的化学方程式;
(2)按定义计算用H2 表示该反应的平均速率υ(H2)即可;
(3)通过表格种的键能数据,反应中放出的热量等于生成物的总键能减去反应物的总键能;反应的热量变化与实际消耗的反应物的物质的量成正比;
(4)按平衡状态的特征“等”、“定”,判断选项即可;
(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,Y、Z为生成物,当反应到达2min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为:2X3Y+Z;
答案为:2X3Y+Z;
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,则Y为氢气,在此t1 min 时间内,用H2 表示该反应的平均速率 ;
;
答案为:![]() ;
;
(3)合成氨反应为: ![]() ,实际消耗1molN2、3molH2,生成2molNH3,则消耗1molN2吸收能量946 kJ、消耗3molH2吸收能量3×436 kJ、生成2molNH3放出能量6×391 kJ,则1mol N2 完全反应生成NH3时放出92kJ 能量;
,实际消耗1molN2、3molH2,生成2molNH3,则消耗1molN2吸收能量946 kJ、消耗3molH2吸收能量3×436 kJ、生成2molNH3放出能量6×391 kJ,则1mol N2 完全反应生成NH3时放出92kJ 能量;
答案为:92;
但合成氨反应是可逆反应,当1mol N2 完全反应生成NH3时,实际提供的反应物必定大于1molN2和3molH2,若将1molN2和3molH2放在反应容器中,使它们充分反应,实际不可能完全消耗,故反应的热量变化总小于计算值;
答案为:该反应为可逆反应,充分反应的最终结果是达到最大限度时,转化率小于100%,因此放出的热量总是小于理论计算值;
(4)该反应为2X3Y+Z;
A.容器内各气体组分的质量分数不再发生改变,则各成分的浓度不再变化,已达平衡,A符合;
B.容器内气体的压强不再发生改变,则各成分的物质的量、浓度不再变化,B符合;
C.容器内气体的密度不会随着反应而变化,故密度不再发生改变,不能说明已经平衡,C不符合;
D.气体的物质的量、混合气体的平均相对分子质量会随着反应而变化,故混合气体的平均相对分子质量不再发生改变,则各成分的物质的量不再变化说明已达平衡,D符合;
答案为:ABD。

【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D