题目内容
【题目】金刚石具有硬度大、熔点高等特点,大量用于制造钻头、金属切割刀具等。其结构如图所示,下列判断正确的是( )
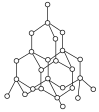
A.金刚石中C—C键的键角均为109°28′,所以金刚石和CH4的晶体类型相同
B.金刚石的熔点高与C—C键的键能无关
C.金刚石中碳原子个数与C—C键键数之比为1∶2
D.金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却
【答案】C
【解析】
A.金刚石是原子晶体,CH4是分子晶体,二者的晶体类型不同,A项错误;
B.金刚石熔化过程中C-C键断裂,因为C-C键的键能大,断裂时需要额能量多,故金刚石的熔点很高,B项错误;
C.金刚石中每个C都参与了4个C-C键的形成,而每个C对每个键的贡献只有一半,故碳原子个数与C-C键个数之比为![]() ,C项正确;
,C项正确;
D.金刚石的熔点高,但在打孔过程中会产生很高的温度,如不浇水冷却钻头,会导致钻头熔化,D项错误;
答案选C。

练习册系列答案
相关题目
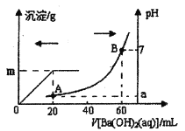
【题目】在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同