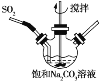
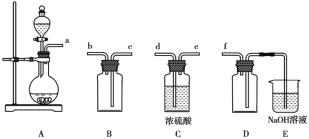
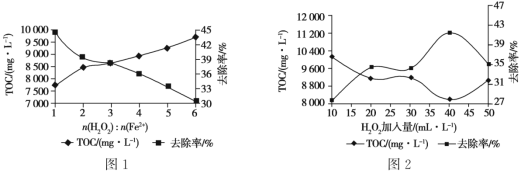
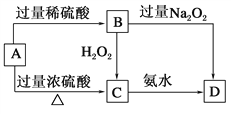
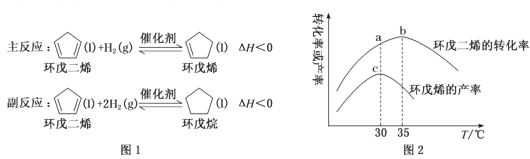
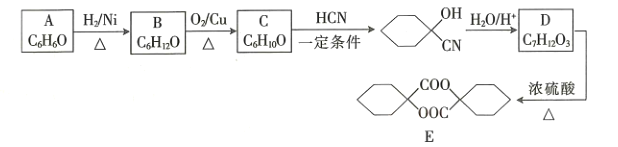
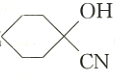
题目内容
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素

(1)表格中最稳定的元素是_____(填元素符号),h在周期表的位置为_____。
(2)元素i的最高价氧化物对应水化物的化学式为_____
(3)c、d、e三种元素对应的原子半径由大到小的顺序为_____(用元素符号表示)
(4)c、h气态氢化物的稳定性强弱关系是_____(用化学式表示)
(5)写出f和i形成的化合物中所含化学键的类型_____
【答案】Ar 第三周期ⅤA族 HClO4 Na>N>O NH3>PH3 离子键
【解析】
由元素在周期表的位置可知,a~j分别为H、C、N、O、Na、Mg、Al、P、Cl、Ar,
(1)稀有气体最稳定,h为P;
(2)i的最高价为+7价;
(3)电子层越多、原子半径越大,同周期从左向右原子半径减小;
(4)非金属性越强,对应氢化物越稳定;
(5)f和i形成的化合物为MgCl2。
由元素在周期表的位置可知,a~j分别为H、C、N、O、Na、Mg、Al、P、Cl、Ar,
(1)表格中最稳定的元素是Ar,h在周期表的位置为第三周期ⅤA族,故答案为:Ar;第三周期ⅤA族;
(2)元素i的最高价氧化物对应水化物的化学式为HClO4,故答案为:HClO4;
(3)c、d、e三种元素对应的原子半径由大到小的顺序为Na>N>O,故答案为:Na>N>O;
(4)c、h气态氢化物的稳定性强弱关系是NH3>PH3,故答案为:NH3>PH3;
(5)f和i形成的化合物中所含化学键的类型为离子键,故答案为:离子键。

【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取一定量固体溶解,向溶液中通入足量的CO,观察到有晶体析出 | 原固体中一定含Na2CO3 |
B | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成 | 原固体中一定含有Na2CO3 |
C | 取一定量固体,溶解,向溶液中滴加适量AgNO3 溶液,观察有白色沉淀生成 | 原固体中一定含有NaCl |
D | 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到有0.88g气体 | 原固体中三种物质都有 |
A.AB.BC.CD.D