题目内容
6.下列说法不正确的有几个( )①C12H8分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2,Cl2,Br2,I2熔点随相对分子质量增大而升高
④NCl3,PCl5,CO2,CS2分子中各原子均达到8e稳定结构
⑤若X的质子数为a,中子数为b,则原子可表示为baX
⑥由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
⑦两种微粒含有相同质子数和电子数,这两种微粒可能是两种不同阴离子或阳离子
⑧原子序数为34号的元素属于长周期的副族元素.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 ①同种元素之间形成非极性共价键,不同元素之间形成极性共价键;
②R2-和M+的电子层结构相同,则离子的核外电子数相等,且M处于R相邻的下一周期;
③组成和结构相似的分子,熔点随相对分子质量增大而升高;
④PCl5中P原子最外层不是8电子;
⑤根据元素符号ZAX的含义,Z代表质子数,A代表质量数,质量数=质子数+中子数;
⑥不能利用非金属性来比较氢化物的水溶液酸性;
⑦分子或原子中质子数=核外电子数,阳离子中质子数=核外电子数+电荷数,阴离子中质子数=核外电子数-电荷数,据此进行判断;
⑧原子序数为34号的元素为Se,属于长周期的主族元素.
解答 解:①C12H8分子中碳元素和碳元素之间形成非极性共价键,碳元素和氢元素之间形成极性共价键,故①正确;
②R2-和M+的电子层结构相同,则离子的核外电子数相等,且M处于R相邻的下一周期;所以原子序数:M>R,故②错误;
③F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量增大而升高,故③正确;
④NCl3、CO2、CS2分子中各原子均达到8e-稳定结构,但PCl5中P原子最外层不是8电子,故④错误;
⑤若X的质子数为a,中子数为b,则原子可表示为aa+bX,故⑤错误;
⑥不能利用非金属性来比较氢化物的水溶液酸性,故⑥错误;
⑦钠离子和铵根离子具有相同的质子数和电子数、氢氧根和氟离子具有具有相同的质子数和电子数,故⑦正确;
⑧原子序数为34号的元素为Se,属于长周期的主族元素,不是副族元素,故⑧错误;
根据分析可知,错误的有5个,
故选D.
点评 本题考查了元素周期表、元素周期律的综合应用,题目难度中等,试题侧重考查学生的总结归纳能力,明确分子、原子、离子中质子数和电子数的关系是解本题的关键.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
15.关于核素${\;}_{16}^{34}$S的叙述错误的是( )
| A. | 质量数为34 | B. | 中子数为18 | ||
| C. | S2-核外电子数为18 | D. | 原子最外层电子数16 |
14.在限定条件下,对个有机物的同分异构体数目(不考虑立体异构)判断正确的是( )
| A | B | C | D | |
| 分子式 | C4H8 | C4H8Cl2 | C4H10O | C5H10O2 |
| 限定条件 | 能发生加成反应 | 只有一个甲基 | 能与钠反应 | 只有一种官能团 |
| 数目 | 3 | 5 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
1.检验某溶液中是否含有K+、Fe3+、Cl-、Mg2+、I-、CO32-、SO42-,限用的试剂有:盐酸硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( )
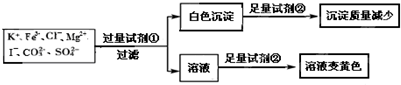

| A. | 该溶液中一定有I-、CO32-、SO42-、K+ | |
| B. | 试剂①为硝酸钡 | |
| C. | 通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl- | |
| D. | 试剂②一定为盐酸 |
11.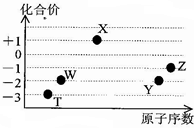 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )| A. | X的氢化物具有很强的还原性 | |
| B. | YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 | |
| C. | Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4>H2YO4 | |
| D. | 元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键 |
18.化学与生活、社会可持续发展密切相关.下列有关叙述不正确的是( )
| A. | 发生铅中毒时,可喝大量的牛奶或鸡蛋清来缓解病情 | |
| B. | CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
15.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+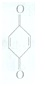 (对苯醌)═N2H4+
(对苯醌)═N2H4+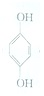 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为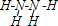 ,该电池正极的电极反应式为
,该电池正极的电极反应式为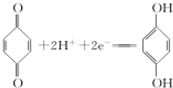 .
.
(2)25℃时.将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl-)时.则溶液的pH=7.
②当混合溶液中,c(NH4+)>c(Cl-)时.则反应的情况可能为a.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K值和温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,b小于(填“大于”、“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为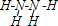 ,该电池正极的电极反应式为
,该电池正极的电极反应式为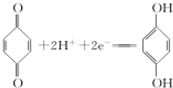 .
.(2)25℃时.将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl-)时.则溶液的pH=7.
②当混合溶液中,c(NH4+)>c(Cl-)时.则反应的情况可能为a.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
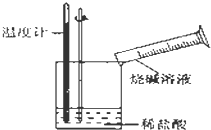 某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.
某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是放热(填“吸热”或“放热”)反应,其离子方程式是H++OH-=H2O.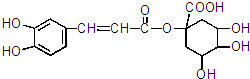 所示:
所示: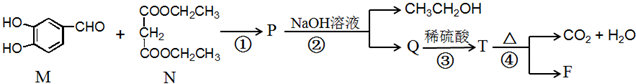

 .
.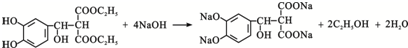 .
.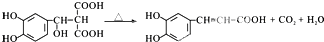 .
.