题目内容
【题目】研究SO2、NOx等大气污染物的要善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.78 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.44 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(SO2)=___mol/(L·min)。
②30min后,只改变某—条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___(填字母)。
A.移除部分CaSO4(s) B.通入一定量的O2
C.加入合适的催化剂 D.适当缩小容器的体积
(2)利用活性炭吸附汽车尾气中的NO:C(s)+2NO(g)![]() N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
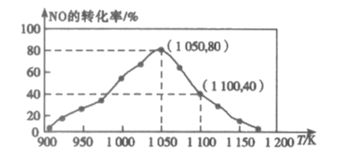
①由图可知:该反应的ΔH___0(填“>”或“<”);在1050K前反应中NO的转化率随温度升高而增大,其原因为___。
②用某物质的平街分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,计算该反应的化学平衡常数Kp=___[已知:气体分压(P分)=气体总压(P×体积分数]。
③达到平衡后,仅升高温度,k正增大的倍数___(填“>”、“<”或“=”)k逆增大的倍数,1100K时,计算k正:k逆=___。
【答案】0.044 BD < 反应未达到平衡状态,温度的升高,反应速率加快,NO转化率增大 4 < 0.11或![]()
【解析】
根据v=![]() 计算;根据30min后,氧气、二氧化碳的浓度都增大,改变的条件可为加入氧气或适当缩小容器的体积等;根据在1050 kPa时反应达到平衡,在1050 kPa前,温度升高对化学反应速率及反应进行的方向分析判断;根据在1100kPa时NO转化率40%,结合三行计算列式得到。
计算;根据30min后,氧气、二氧化碳的浓度都增大,改变的条件可为加入氧气或适当缩小容器的体积等;根据在1050 kPa时反应达到平衡,在1050 kPa前,温度升高对化学反应速率及反应进行的方向分析判断;根据在1100kPa时NO转化率40%,结合三行计算列式得到。
(1)①根据v=![]() ,CO2的化学反应速率v(CO2)=
,CO2的化学反应速率v(CO2)=![]() =0.044mol/(Lmin),根据方程式可知:物质反应的速率比等于化学方程式的化学计量数的比,所以v(SO2)=v(CO2)=0.044mol/(Lmin),故答案为:0.044;
=0.044mol/(Lmin),根据方程式可知:物质反应的速率比等于化学方程式的化学计量数的比,所以v(SO2)=v(CO2)=0.044mol/(Lmin),故答案为:0.044;
②30min后,氧气、二氧化碳的浓度都增大,可为加入氧气或适当缩小容器的体积等,故答案为:BD;
(2)①由图像可知,当温度高于1050K时,随着温度升高,NO的转化率降低,则平衡逆向移动,因此该反应的正反应为放热反应,即ΔH<0,1050kPa 前,反应b 中NO2转化率随着温度升高而增大是由于1050kPa前反应未达平衡状态,随着温度升高,反应速率加快,更多的反应物变为生成物,因此NO2转化率随温度的升高而增大,故答案为:<;反应未达到平街状态,温度的升高,反应速率加快,NO转化率增大;
②由图像可知,在1050K、1.1×106Pa时,NO转化率80%,可列平衡三段式为:

由于容器的容积不变,因此气体的物质的量的比等于气体压强之比,可知平衡时p(NO)=0.2p(总),p(N2)=0.4 p(总),p(CO2)=0.4 p(总),则用平衡分压表示的化学平衡常数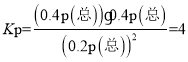 ,故答案为:4;
,故答案为:4;
③正反应为放热反应,升高温度平衡向左移动,则正反应速率增大的倍数小于逆反应速率增大的倍数,浓度不变,故k正增大的倍数小于k逆增大的倍数,1100K时,NO的平衡转化率为40%,可列平衡三段式为:
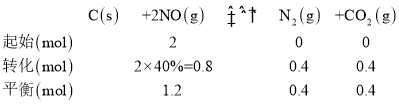
则平衡常数K=![]() ,当反应达到平衡时,υ正=υ逆,故
,当反应达到平衡时,υ正=υ逆,故![]() ,故答案为:<;0.11或
,故答案为:<;0.11或![]() 。
。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案