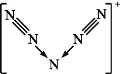
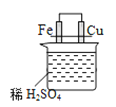
题目内容
【题目】(1)科研人员设想用如图所示装置生产硫酸。
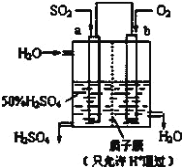
①上述生产硫酸的总反应方程式为_____,b 是_____极,b 电极反应式为______________,生产过程中H+向_____(填 a 或 b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置一定需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
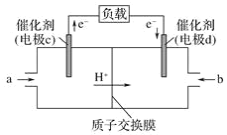
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)质子交换膜左右两侧的溶液均为1L 2mol·L-1H2SO4溶液。燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为___________________________。当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。
【答案】2SO2+O2+2H2O=2H2SO4 正 O2+4e-+4H+=2H2O b D 负极 CH3OH-6e-+H2O=CO2+6H+ 12g
【解析】
(1)原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此判断;
(2)根据电子的移动方向判断正负极,进而书写电极反应式。
(1)①根据装置图可知a电极通入二氧化硫,二氧化硫发生失去电子的氧化反应,氧气在正极通入,因此上述生产硫酸的总反应方程式为2SO2+O2+2H2O=2H2SO4,b通入氧气,是正极,氧气在酸性条件下得电子产生水,反应式为O2+4e-+4H+=2H2O,原电池中阳离子向正极移动,则生产过程中H+向b电极区域运动;
②A.原电池反应的过程中一定有电子发生转移,选项A错误;
B.原申池装置不一定需要2个活泼性不同的金属电极,例如燃料电池等,选项B错误;
C.原电池中电极可以参加反应,例如铜、锌、稀硫酸组成的原电池中锌电极参加反应,选项C错误;
D.原电池中氧化反应和还原反应可以拆开在两极发生,选项D正确;
答案选D;
(2)根据装置图可知电子从c电极流出,则c电极是负极,电池总反应为2CH3OH+3O2=2CO2+4H2O,所以甲醇在负极发生失去电子的氧化反应转化为二氧化碳,则c电极反应方程式为CH3OH-6e-+H2O=CO2+6H+;
负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移1mol电子时,左侧质量减轻![]() ×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×
×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×![]() =8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g。
=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g。