题目内容
【题目】如图所示三套实验装置,分别回答下列问题.
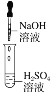
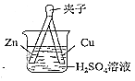
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______.
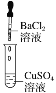
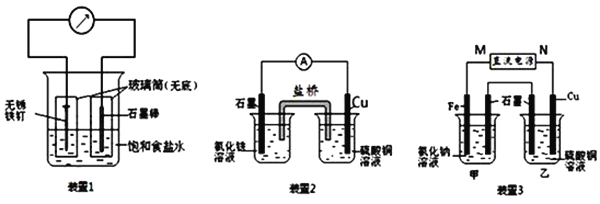
(2)装置2中的石墨是______极(填“正”或“负”),该装置发生的总反应的离子方程式为______.
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为______极;甲烧杯中铁电极的电极反应为______.
②乙烧杯中电解反应的离子方程式为______.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为______mL.
【答案】O2+4e﹣+2H2O═4OH﹣ 正 2Fe3++Cu═2Fe2++Cu2+ 正 Fe﹣2e﹣═Fe2+ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 224
2Cu+O2↑+4H+ 224
【解析】
(1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,观察到碳棒附近的溶液变红,说明在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O═4OH-,
故答案为:O2+4e-+2H2O═4OH-;
(2)装置2为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2 Fe3++2e-═2Fe2+,反应的总方程式为2Fe3++Cu═2Fe2++Cu2+,
故答案为:正;2Fe3++Cu═2Fe2++Cu2+;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;Fe-2e-═Fe2+;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
故答案为:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,根据甲烧杯产生气体的电极反应计算生成气体的体积,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V1
V1=![]() =0.224L,即224ml,
=0.224L,即224ml,
故答案为:224;

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑
【题目】研究SO2、NOx等大气污染物的要善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.78 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.44 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(SO2)=___mol/(L·min)。
②30min后,只改变某—条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___(填字母)。
A.移除部分CaSO4(s) B.通入一定量的O2
C.加入合适的催化剂 D.适当缩小容器的体积
(2)利用活性炭吸附汽车尾气中的NO:C(s)+2NO(g)![]() N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
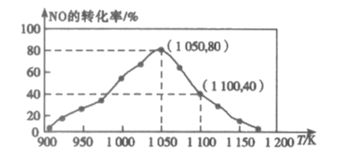
①由图可知:该反应的ΔH___0(填“>”或“<”);在1050K前反应中NO的转化率随温度升高而增大,其原因为___。
②用某物质的平街分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,计算该反应的化学平衡常数Kp=___[已知:气体分压(P分)=气体总压(P×体积分数]。
③达到平衡后,仅升高温度,k正增大的倍数___(填“>”、“<”或“=”)k逆增大的倍数,1100K时,计算k正:k逆=___。