题目内容
【题目】某矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:称取25.0 g样品溶于稀硫酸中,加热搅拌,滤去不溶物。向滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,消耗KMnO4溶液25.00 mL。
(1)该铁矿石中铁元素的质量分数为________(保留三位有效数字);
(2)氧化物FemOn的化学式中m=____,n=____(m、n为正整数)。
【答案】56.0% 5 7
【解析】
溶于稀硫酸后的滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g,则10.0g-3.6g=6.4g铜和铁离子反应,据此可计算Fe3+物质的量;剩下滤液中铁元素全部以Fe2+存在,其物质的量可通过2 mol·L-1的酸性KMnO4滴定所消耗KMnO4溶液25.00 mL计算所得,据此计算;
(1)据分析,剩下滤液中铁元素全部以Fe2+存在,则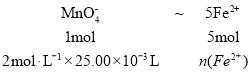 ,解得n(Fe2+)=0.25 mol,根据Fe守恒,剩下滤液中铁元素质量即为该铁矿石中铁元素总量,则该铁矿石中铁元素的质量分数为
,解得n(Fe2+)=0.25 mol,根据Fe守恒,剩下滤液中铁元素质量即为该铁矿石中铁元素总量,则该铁矿石中铁元素的质量分数为![]() = 56.0% ;
= 56.0% ;
答案为:56.0% ;
(2) 25.0 g样品溶于稀硫酸中,且6.4g铜和其中的铁离子发生反应:![]() ,则n(Fe3+)=2n(Cu)=2×
,则n(Fe3+)=2n(Cu)=2×![]() =0.2mol,则25.0 g样品溶于稀硫酸所得溶液中含有Fe2+为0.25 mol-0.2mol=0.05mol,则亚铁离子和铁离子的物质的量之比为0.05mol:0.2mol=1:4,故氧化物可表示为:FeO·2Fe2O3,即氧化物为Fe5O7,则m=5,n=7;
=0.2mol,则25.0 g样品溶于稀硫酸所得溶液中含有Fe2+为0.25 mol-0.2mol=0.05mol,则亚铁离子和铁离子的物质的量之比为0.05mol:0.2mol=1:4,故氧化物可表示为:FeO·2Fe2O3,即氧化物为Fe5O7,则m=5,n=7;
答案为:5;7。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案
相关题目