题目内容
【题目】我国制碱专家侯德榜先生潜心研究制碱技术,发明了侯氏制碱法。工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程如下:
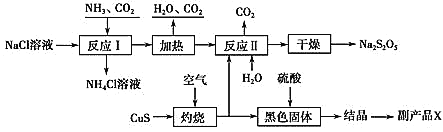
已知:反应Ⅱ包含2NaHSO3Na2S2O5+H2O等多步反应。
(1) 反应Ⅰ的化学方程式为________;在进行反应Ⅰ时,向NaCl溶液中先通入_______(填“CO2”或“NH3”);
(2)“灼烧”时发生反应的化学方程式为__________;
(3)已知Na2S2O5与稀硫酸反应放SO2,其离子方程式为__________。
(4)副产品X化学式为________;生产中可循环利用的物质为____________(化学式)。
(5)为了减少产品Na2S2O5中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为_________,若气体量不足,则会导致___________________,检验产品中是否含有碳酸钠杂质,所需试剂是_________(填编号)。
①酸性高锰酸钾溶液 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH溶液 ⑥稀盐酸
【答案】NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl NH3 2CuS+3O2![]() 2CuO+2SO2 S2O52—+2H+═2SO2↑+H2O CuSO4·5H2O CO2 2:1 若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低 ①③⑥
2CuO+2SO2 S2O52—+2H+═2SO2↑+H2O CuSO4·5H2O CO2 2:1 若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低 ①③⑥
【解析】
根据侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程,饱和氯化钠溶液与二氧化碳、氨气反应生成碳酸氢钠,碳酸氢钠分解生成碳酸钠、水和二氧化碳,灼烧时, CuS与氧气反应生成黑色氧化铜和二氧化硫气体,把二氧化硫气体通入碳酸钠溶液生成NaHSO3,同时放出二氧化碳气体,2NaHSO3Na2S2O5+H2O,蒸干得到Na2S2O5固体。氧化铜与稀硫酸反应生成硫酸铜溶液,蒸发浓缩、冷却结晶、过滤、洗涤,得到硫酸铜晶体。
(1) 反应Ⅰ是饱和氯化钠溶液与二氧化碳、氨气反应生成碳酸氢钠和氯化铵,反应方程式为NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;在进行反应Ⅰ时,向NaCl溶液中先通入NH3,使溶液呈碱性,碱性条件下,能增大二氧化碳的溶解度;
(2)“灼烧”时,CuS与氧气反应生成黑色氧化铜和二氧化硫气体,发生反应的化学方程式为2CuS+3O2![]() 2CuO+2SO2;
2CuO+2SO2;
(3) Na2S2O5与稀硫酸反应生成硫酸钠、SO2、H2O,其离子方程式为S2O52-+2H+═2SO2↑+H2O。
(4) 氧化铜与稀硫酸反应生成硫酸铜溶液,蒸发浓缩、冷却结晶、过滤、洗涤,得到硫酸铜晶体,所以副产品X化学式为CuSO4·5H2O;根据流程图可知,生产中可循环利用的物质为CO2。
(5) Na2S2O5中钠与硫元素的原子数比是1:1,根据元素守恒,理论上需控制反应Ⅱ中SO2与固体Na2CO3反应物的物质的量之比为2:1;若SO2不足,Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加;检验产品中是否含有碳酸钠杂质,操作步骤是:取样品,加入足量稀盐酸,生成的气体通入足量的高锰酸钾溶液,除去二氧化硫,最后把气体通入澄清石灰水,若溶液变浑浊,则含有碳酸钠杂质,需要的试剂是①③⑥。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D