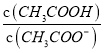题目内容
【题目】X.Y、Z、W四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
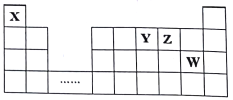
A. 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y)
B. X、Y、Z既能形成离子化合物,又能形成共价化合物
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D. H2Z的熔点比HW高,是因为它们的晶体类型不同
【答案】B
【解析】根据元素周期表的结构,X为H,Y为N,Z为O,W为Cl,A、原子半径有r(Cl)>r(N)>r(O)>r(H),故A错误;B、H、N、O可以构成HNO3,HNO3属于共价化合物,可以构成NH4NO3,NH4NO3属于离子化合物,故B正确;C、构成的10e-微粒有NH3、NH4+、H2O、H3O+等,故C错误;D、H2Z为H2O,HW为HCl,常温下H2O为液态,HCl为气态,H2O的熔点比HCl高,是因为H2O中存在分子间氢键,HCl不含,晶体类型都属于分子晶体,故D错误。

练习册系列答案
相关题目