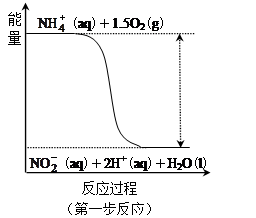题目内容
有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种微粒,分别属于同一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8:1 |
| B.还原产物为NH+4 |
| C.若有l mol NO-3参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+—e-=Fe3+ |
A
解析试题分析:硝酸根离子在酸性条件下具有强氧化性,能将亚铁离子氧化成铁离子,离子方程式为:8Fe2++NO3-+10H+=NH4++8Fe3++3H2O。氧化剂与还原剂的物质的量之比为1:8,A错误;硝酸根离子为氧化剂,发生还原反应,故铵根离子为还原产物,B正确;硝酸根离子中的氮呈+5价,铵根离子中的氮呈-3价,若有l mol NO-3参加还原反应,则转移8mol e-,C正确;亚铁离子发生氧化反应,设计成原电池,亚铁离子则在负极发生反应,D正确。
考点:氧化还原反应
点评:氧化还原反应是高考的必考内容,考生应把握以下两点:一、判断一个反应是否属于氧化还原反应,以及氧化剂(产物)、还原剂(产物)分别是什么;二、利用得失电子配平所给化学反应,并能进行简单的有关于电子守恒的计算。

练习册系列答案
相关题目
氢化铝钠(NaAlH4)是最冇研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是
| A.NaAlH4中氢元素为+1价 |
| B.每生成11. 2 L(标准状况下)H2,转移2NA个电子 |
| C.在反应中有50%的氢被氧化 |
| D.反应中氧化产物与还原产物的物质的量之比为1: 1 |
三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
| A.NF3的氧化性比F2强 |
| B.NF3的还原性比NH3强 |
| C.NF3中的原子最外层均达8电子 |
| D.该反应过程转移了6 mol电子。 |
在NO2与水的反应中,NO2
| A.只是还原剂 |
| B.只是氧化剂 |
| C.既是还原剂,又是氧化剂 |
| D.既不是还原剂,又不是氧化剂 |
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是
| A.产物PH3分子中所有的原子可能共平面 |
| B.该反应中P做还原剂,H2O做氧化剂 |
| C.相关元素的第一电离能的大小顺序:S>P>Si |
| D.该反应每发生0.3摩尔电子转移,PH3分子中就有0.3摩尔P-H键形成 |
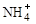 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下: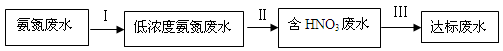
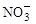 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下: