题目内容
在NO2与水的反应中,NO2
| A.只是还原剂 |
| B.只是氧化剂 |
| C.既是还原剂,又是氧化剂 |
| D.既不是还原剂,又不是氧化剂 |
C
解析试题分析:NO2与水反应的化学方程式是3NO2+H2O=2HNO3+NO,在反应中氮元素的化合价从+4价部分升高到+5价,部分降低到+2价,所以NO2既是氧化剂,又是还原剂,答案选C。
考点:考查氧化还原反应的有关判断
点评:该题是高考中的常见考点,主要是考查学生对氧化还原反应中还原剂和氧化剂的含义以及判断的熟悉了解程度,难度不大。准确判断出氮元素的化合价变化情况是该题的关键,学生不难得分。

 全优点练单元计划系列答案
全优点练单元计划系列答案氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )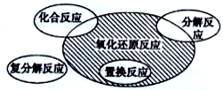
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3  Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
| A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
化学在日常生活中具有广泛的应用,下列应用中不涉及氧化还原反应原理的是
| A.用明矾[KAl(SO4)2·12H2O]净水 | B.海水中提取溴 |
| C.交警用CrO3检验司机是否酒后驾驶 | D.医务室用双氧水消毒 |
除废气NO的反应原理为:2CO+2NO=N2+2CO2有关该反应的说法不正确的是 ( )
| A.反应中CO为氧化剂 |
| B.反应中NO被还原 |
| C.在反应生成1 mol N2时,转移的电子为4 mol |
| D.CO和NO都是无色有毒气体 |
有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种微粒,分别属于同一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8:1 |
| B.还原产物为NH+4 |
| C.若有l mol NO-3参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+—e-=Fe3+ |
(10分)为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
。
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①将 通入酸性
通入酸性 溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是 。
溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是 。
| A.S2- | B.S | C.SO32- | D.SO42- |
请选取合适的试剂证明Na2SO3具有还原性, 并写出该反应的离子方程式为: .
(2)从物质分类的角度可以推测物质的性质。
①已知蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。其中属于碱性氧化物的是 。
②现取一份蛇纹石试样进行实验:
I.先将其溶于过量的盐酸中、过滤,滤渣的主要成分是 。
II.再向滤液中加入NaOH溶液至过量、过滤,滤渣中的主要成分是 。