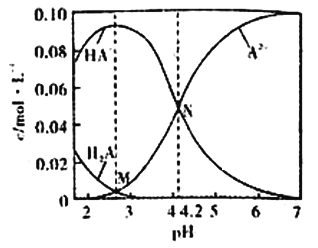
题目内容
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。
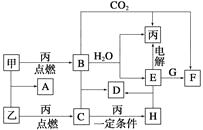
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C—→D的化学方程式:__________________________________;
写出E+G—→F的离子方程式:____________________________________。
【答案】 O 2 SO 3 ![]() 增强溶液的导电能力 Na 2 O 2 +SO 2 ===Na 2 SO 4 OH - +HCO 3 - ===CO 3 2- +H 2 O
增强溶液的导电能力 Na 2 O 2 +SO 2 ===Na 2 SO 4 OH - +HCO 3 - ===CO 3 2- +H 2 O
【解析】
甲、乙、丙为常见单质,A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,均含有Na元素,B能与二氧化碳、水反应生成单质丙,则B为Na2O2,丙为O2,甲为Na,E为NaOH,F为Na2CO3,G的焰色反应为黄色,与氢氧化钠反应得到碳酸钠,判断G为NaHCO3;C能使品红溶液褪色,由单质乙与氧气反应得到,则乙为S,A为Na2S,C为SO2,H为SO3,D为Na2SO4,据此解答。
根据上述分析,甲为Na,乙为S,丙为O2,A为Na2S,B为Na2O2,C为SO2,D为Na2SO4,E为NaOH,F为Na2CO3,G为NaHCO3,H为SO3。
(1)丙为O2,H为SO3,故答案为:O2;SO3;
(2)A为Na2S,属于离子化合物,电子式为 ![]() ,故答案为:
,故答案为:![]() ;
;
(3)电解NaOH的水溶液时,实质是电解水,NaOH起到的作用是:增强溶液导电能力,故答案为:增强溶液导电能力;
(4)B+C→D是过氧化钠与二氧化硫反应生成硫酸钠,反应化学方程式为:Na2O2+SO2=Na2SO4;E和G是氢氧化钠和碳酸氢钠溶液的反应,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,故答案为:Na2O2+SO2=Na2SO4;HCO3-+OH-=CO32-+H2O。