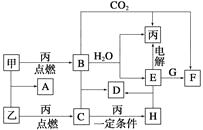
题目内容
【题目】甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
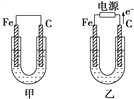
(1)若两池中电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:______________________________________
②甲池中碳极上电极反应式是_______________________________________,
乙池中碳极上电极反应属于________(填“氧化反应”或“还原反应”)。
【答案】 碳 铁 4OH--4e-===2H2O+O2↑ 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 2H2O+O2+4e-===4OH- 氧化反应
Cl2↑+H2↑+2OH- 2H2O+O2+4e-===4OH- 氧化反应
【解析】(1)①由装置图可知,甲为原电池,乙为电解池;若两池中电解质溶液均为CuSO4溶液,原电池中活泼金属作负极,失电子发生氧化反应,碳棒做正极,溶液中的Cu2+在正极上得到电子生成铜单质,碳棒上有Cu析出;电解池中外电路电子流入电源正极,所以碳棒为阳极,铁棒为阴极,阴极上发生还原反应,Cu2+得电子生成铜单质,所以铁棒上有Cu析出。②乙池中,惰性电极碳棒作阳极电解硫酸铜溶液,阳极上OH-放电生成氧气,电极反应为:4OH--4e-=2H2O+O2↑。
(2)若两池中均为饱和NaCl溶液,则甲池为铁的吸氧腐蚀原电池装置,乙池是用惰性电极作阳极电解饱和NaCl溶液装置。①用惰性电极作阳极电解饱和NaCl溶液,生成氢氧化钠、氢气和氯气,总反应的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。②甲池中铁棒作负极,碳棒作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-;乙池中碳棒作阳极,发生氧化反应。
2OH-+H2↑+Cl2↑。②甲池中铁棒作负极,碳棒作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-;乙池中碳棒作阳极,发生氧化反应。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案