题目内容
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
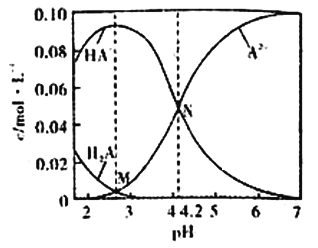
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
【答案】C
【解析】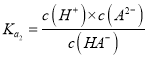 ,选取图中N点,此时pH=4.2,A2-和HA-的浓度相等,所以
,选取图中N点,此时pH=4.2,A2-和HA-的浓度相等,所以 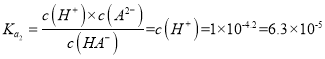 ,所以Ka2(H2A)的数量级为10-5,选项A正确。图中看出当HA-的浓度占主导地位的时候,pH为2到3之间,所以NaHA溶液显酸性,即c(H+)>c(OH-),选项B正确。M、N都显酸性,溶质电离的氢离子对于水的电离都起到抑制作用,因为从M到N,溶液的pH升高,溶质电离出来的氢离子浓度减小,所以对于水的电离的抑制减弱,N点水电离的氢离子浓度更大,选项C错误。溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(OH-) + 2c(A2-) + c(HA-),中性溶液中氢离子和氢氧根离子浓度相等,所以有c(Na+)=2c(A2-) + c(HA-),则c(Na+)>2c(A2-),选项D正确。
,所以Ka2(H2A)的数量级为10-5,选项A正确。图中看出当HA-的浓度占主导地位的时候,pH为2到3之间,所以NaHA溶液显酸性,即c(H+)>c(OH-),选项B正确。M、N都显酸性,溶质电离的氢离子对于水的电离都起到抑制作用,因为从M到N,溶液的pH升高,溶质电离出来的氢离子浓度减小,所以对于水的电离的抑制减弱,N点水电离的氢离子浓度更大,选项C错误。溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(OH-) + 2c(A2-) + c(HA-),中性溶液中氢离子和氢氧根离子浓度相等,所以有c(Na+)=2c(A2-) + c(HA-),则c(Na+)>2c(A2-),选项D正确。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目