��Ŀ����
����Ŀ��������Ҫ�İ뵼����ϣ��ǹ����ִ����ӹ�ҵ�Ļ������輰�仯�����ڹ�ҵ��Ӧ�ù㷺���ڹ�ҵ�ϣ��ߴ������ͨ������������ȡ��
![]()
����������:
��1����ԭ�Ӻ�����_______�ֲ�ͬ�����ĵ��ӣ���ԭ�ӵĺ�������Ų�ʽ��_______________��
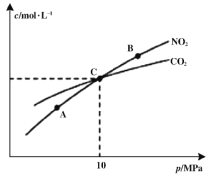
��2��̼�������ͬ����Ԫ�أ��۷е�SiO2 ________CO2 (��д��>������<����=��)����ԭ����_____________________________________________________��
��3����������SiO2�ƴֹ�ķ�Ӧ����˵��̼�ķǽ�����ǿ�ڹ裬ԭ����_________________����д��һ����˵��̼�ķǽ�����ǿ�ڹ�Ļ�ѧ����ʽ______________________________��
��4��SiHCl3(g) + H2(g)![]() Si(s) + 3HCl(g) ��Q ��Q>0��
Si(s) + 3HCl(g) ��Q ��Q>0��
��������Ӧ��ƽ�ⳣ������ʽK��_____________����ʹK����Ĵ�ʩ��_______________��
��һ�������£��ڹ̶��ݻ����ܱ������У��ܱ�ʾ������Ӧ�ﵽƽ��״̬����________��ѡ���ţ���
a��3v��(SiHCl3)��v��(HCl) b����������ѹǿ����
c��K���ֲ��� d��c(SiHCl3)��c(H2)��c(HCl)��1��1��3
��һ���¶��£���2L�ܱ������н���������Ӧ��5min��ﵽƽ�⣬�˹����й�����������0.28g����ʱHCl�Ļ�ѧ��Ӧ����Ϊ ________________ ��
���𰸡�5 1s22s22p63s23p2 > SiO2��ԭ�Ӿ��壬�ڻ�ʱ��Ҫ�˷����ۼ���CO2�Ƿ��Ӿ��壬�ڻ�ʱֻ��Ҫ�˷����Ӽ�������������SiO2���۷е��CO2���۷е�ߡ� �ǽ�������ָ�ǽ���Ԫ�صĵ����ڻ�ѧ��Ӧ�еõ����ӵ���������̼��������跴Ӧ�����ֳ�������̼ʧȥ���ӵ���������ԭ�ԣ�����˲���˵��̼�ķǽ����Աȹ�ǿ Na2SiO3+2CO2+2H2O ��2NaHCO3+H4SiO4����CO2+Na2SiO3+H2O ��H2SiO3��+Na2CO3 K=c(HCl)3/ c (SiHCl3) c (H2) ���� a b 0.003 mol/(L��min)
��������
��1��ԭ�Ӻ�������м����ܼ����м���������ͬ�Ĺ����Siԭ������Ϊ14����3�����Ӳ㣬����������Ϊ4��
��2���۵�һ��Ϊԭ�Ӿ��壾���Ӿ��壾�������壾���Ӿ��壻
��3��̼��������跴Ӧ���ɹ赥�ʺ�һ����̼��ֻ��˵��̼�Ļ�ԭ�Աȹ�ǿ��ǿ�ᷴӦ��ȡ���
��4������ƽ�ⳣ������д������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ�ȵ��ݴη��˻��õ���ƽ�ⳣ�����¶ȱ仯��
��5���ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ٷֺ������䣬�Լ��ɴ�����������һЩ�����䣬�ݴ˷�����
��6�����ݷ���ʽ�����������������0.28gʱ���ɵ��Ȼ�������ʵ���������![]() ���㡣
���㡣
����1����ԭ�Ӻ�����1s��2s��2p��3s��3p�����ܼ���������ԭ�Ӻ�����5�ֲ�ͬ�����Ĺ����Siԭ������Ϊ14����3�����Ӳ㣬����������Ϊ4���ʹ�ԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p2��
�ʴ�Ϊ��5��1s22s22p63s23p2��
��2���۵�һ��Ϊԭ�Ӿ��壾���Ӿ��壾�������壾���Ӿ��壬SiO2Ϊԭ�Ӿ��壬�ڻ�ʱ��Ҫ�˷����ۼ���CO2Ϊ���Ӿ��壬�ڻ�ʱֻ��Ҫ�˷����Ӽ������������۷е㣺SiO2��CO2��
�ʴ�Ϊ������SiO2��ԭ�Ӿ��壬�ڻ�ʱ��Ҫ�˷����ۼ���CO2�Ƿ��Ӿ��壬�ڻ�ʱֻ��Ҫ�˷����Ӽ�������������SiO2���۷е��CO2���۷е�ߣ�
��3��̼��������跴Ӧ���ɹ赥�ʺ�һ����̼��![]() ��ֻ��˵��̼�Ļ�ԭ�Աȹ�ǿ���ǽ�������ָ�ǽ���Ԫ�صĵ����ڻ�ѧ��Ӧ�еõ����ӵ���������̼��������跴Ӧ�����ֳ�������̼ʧȥ���ӵ���������ԭ�ԣ�����˲���˵��̼�ķǽ����Աȹ�ǿ��̼�ķǽ����Աȹ�ǿ����̼������Ա�ԭ���ᣨ���ᣩǿ���ɷ�����Na2SiO3+2CO2+2H2O=2NaHCO3+H4SiO4����CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3��
��ֻ��˵��̼�Ļ�ԭ�Աȹ�ǿ���ǽ�������ָ�ǽ���Ԫ�صĵ����ڻ�ѧ��Ӧ�еõ����ӵ���������̼��������跴Ӧ�����ֳ�������̼ʧȥ���ӵ���������ԭ�ԣ�����˲���˵��̼�ķǽ����Աȹ�ǿ��̼�ķǽ����Աȹ�ǿ����̼������Ա�ԭ���ᣨ���ᣩǿ���ɷ�����Na2SiO3+2CO2+2H2O=2NaHCO3+H4SiO4����CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3��
�ʴ�Ϊ���ǽ�������ָ�ǽ���Ԫ�صĵ����ڻ�ѧ��Ӧ�еõ����ӵ���������̼��������跴Ӧ�����ֳ�������̼ʧȥ���ӵ���������ԭ�ԣ�����˲���˵��̼�ķǽ����Աȹ�ǿ��Na2SiO3+2CO2+2H2O=2NaHCO3+H4SiO4����CO2+Na2SiO3+H2O=H2SiO3��+Na2CO3��
��4��![]() -Q��Q��0��������ƽ�ⳣ��������д��ע�����ʹ�Һ�岻д�����ʽ������ʽΪK=c(HCl)3/ c (SiHCl3) c (H2)���÷�Ӧ����ӦΪ���ȷ�Ӧ�����������¶�ƽ�����ƶ���ƽ�ⳣ������
-Q��Q��0��������ƽ�ⳣ��������д��ע�����ʹ�Һ�岻д�����ʽ������ʽΪK=c(HCl)3/ c (SiHCl3) c (H2)���÷�Ӧ����ӦΪ���ȷ�Ӧ�����������¶�ƽ�����ƶ���ƽ�ⳣ������
�ʴ�Ϊ��K=c(HCl)3/ c (SiHCl3) c (H2)�����£�
��5��a��3v����SiHCl3��=v����HCl�������淴Ӧ������ȣ���a��ȷ��
b���淴Ӧ����������ѹǿ����������ѹǿ���䣬˵������ƽ�⣬��b��ȷ��
c��ƽ�ⳣ�����¶ȱ仯���¶Ȳ���K���ֲ��䣬����˵�����淴Ӧ������ȣ���c����
d��c��SiHCl3����c��H2����c��HCl��=1��1��3����˵�����淴Ӧ������ȣ���d����
�ʴ�Ϊ��ab��
��6��![]() ���˹����й�����������0.28g�������Ȼ�������ʵ���Ϊ0.03mol��
���˹����й�����������0.28g�������Ȼ�������ʵ���Ϊ0.03mol��![]() =0.003mol/��Lmin����
=0.003mol/��Lmin����
�ʴ�Ϊ��0.003mol/��Lmin����

����Ŀ����ҵ�����̶���������CO2����Ч�ؼ���������ЧӦ����
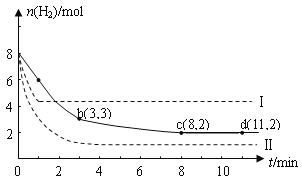
I����ҵ�������о�����CO2�������״�ȼ�ϵķ������÷����Ļ�ѧ����ʽ�ǣ�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-49.0kJmol��1��ij��ѧʵ�齫6molCO2��8 molH2����һ�ݻ�Ϊ2L���ܱ�������(�¶ȱ��ֲ���)�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩��
CH3OH(g)+H2O(g) ��H=-49.0kJmol��1��ij��ѧʵ�齫6molCO2��8 molH2����һ�ݻ�Ϊ2L���ܱ�������(�¶ȱ��ֲ���)�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩��
�ش��������⣺
��1������˵������ȷ������__________��
A��0��1min��ƽ����Ӧ���ʴ���3��4min��ƽ����Ӧ����
B���ﵽƽ��ʱH2��ת����Ϊ75%
C�� ��������������ʱ������߷�Ӧ���¶�����Ӧ���������淴Ӧ���ʼ�С
��2���÷�Ӧ��0 ��8 min��CO2��ƽ����Ӧ������_______��
��3���÷�Ӧ��ƽ�ֳ���K=______________��
��4�����ı�ijһ�����ٽ���ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ����ʵ����ȣ�����I�ı������������_________����ʵ�߶�Ӧ������ƽ�ⳣ��ΪK������I��Ӧ������ƽ�ⳣ��ΪK1������II��Ӧ������ƽ�ⳣ��ΪK2����K��K1��K2�Ĵ�С��ϵ��____��
II����֪25��ʱ�������̼��ĵ���ƽ�ⳣ�����±���
���ʵĻ�ѧʽ | CH3COOH | H2CO3 | |
����ƽ�ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 | K2=5.6��10��11 |
��1���ñ��Ͱ�ˮ����CO2�ɵõ�NH4HCO3��Һ������֪CH3COONH4��ҺpH=7����(NH4)2CO3��Һ��_____(������������������������������)��
��2��25��ʱ����0��lmolL��1������Һ�м���һ������NaHCO3�������¶Ȳ��䣬���û��Һ��pH=6����ô���Һ��![]() =_______���û����Һ�е�����Ũ���ɴ�С��˳��Ϊ��________________��
=_______���û����Һ�е�����Ũ���ɴ�С��˳��Ϊ��________________��