题目内容
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
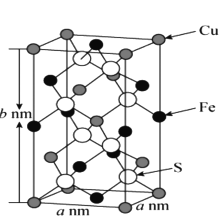
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
【答案】16 1s22s22p63s23p63d6(或[Ar]3d6) 三角锥形 N2或CO CuCl为分子晶体,CuF为离子晶体,离子晶体的熔沸点比分子晶体高 sp3 低 乙醇分子间有氢键,而乙硫醇没有 CuFeS2 ![]()
【解析】
(1)硫元素为16号元素,核外有16个电子,9个轨道;铁为26号元素,核外有26个电子,失去最外层的2个电子变成Fe2+;
(2)根据SO32-的杂化方式为sp3确定它的空间结构,由等电子体定义确定SO2+的等电子体的分子;
(3)根据两种晶体的性质确定晶体类型;
(4)根据乙硫醇中硫原子的成键特点判断杂化方式,乙醇分子里有氧,可以形成氢键导致沸点比较高;
(5)根据晶胞结构中Cu、Fe、S原子个数计算出化学式,再由有关公式写出晶胞密度的表达式;
根据以上分析进行解答。
(1)基态原子核外有多少个轨道就有多少个空间运动状态。硫原子的电子排布式为:1s22s22p63s23p4,故硫原子1+1+3+1+3=9个轨道,所以基态硫原子中核外电子有9种空间运动状态;Fe是26号元素,核外有26个电子,铁原子失去最外层的两个电子变成Fe2+,Fe2+的电子排布式是1s22s22p63s23p63d6(或[Ar]3d6)。
答案为:9;1s22s22p63s23p63d6(或[Ar]3d6)。
(2)SO32-离子中的硫原子有三个化学键,一对孤对电子,属于sp3杂化,空间构型为三角锥形;SO2+有两个原子,总价电子数为10,与SO2+互为等电子体的分子有N2、CO等。
答案为:三角锥形;N2或CO。
(3)由题知CuCl熔点为426℃,融化时几乎不导电,可以确定CuCl为分子晶体,熔沸点比较低,CuF的熔点为908℃,沸点1100℃,确定CuF为离子晶体,熔沸点比较高。
答案为:CuCl为分子晶体,CuF为离子晶体,离子晶体的熔沸点比分子晶体高。
(4)乙硫醇(C2H5SH)里的S除了共用的两对电子外还有两对孤对电子要参与杂化,所以形成的是sp3杂化,乙醇里有电负性较强的氧原子,分子间可以形成氢键,沸点比乙硫醇的沸点高。
答案:sp3;低;乙醇分子间有氢键,而乙硫醇没有。
(5)对晶胞结构分析可知,晶胞中的Cu原子数目=8![]() +4
+4![]() +1=4,Fe原子数目=6
+1=4,Fe原子数目=6![]() +4
+4![]() =4,S原子数目为8, X的化学式中原子个数比为:Cu:Fe:S=1:1:2,所以X的化学式为:CuFeS2。
=4,S原子数目为8, X的化学式中原子个数比为:Cu:Fe:S=1:1:2,所以X的化学式为:CuFeS2。
由图可知晶胞内共含4个“CuFeS2”,据此计算:晶胞的质量=4![]() =
=![]() ,晶胞的体积V=anmanmbnm=a2b10-21cm3,所以晶胞的密度=
,晶胞的体积V=anmanmbnm=a2b10-21cm3,所以晶胞的密度=![]() =
= 。
。
答案为:CuFeS2;![]() 。
。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案