题目内容
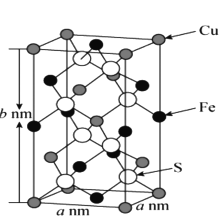
【题目】全氮类物质因具有超高能量而成为超高含能材料的典型代表。我国科学家成功合成了全氮阴离子盐——(N5)6(H3O)3(NH4)4Cl,是该领域的重大突破。
(1)氮的原子结构示意图为________。
(2)构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+和________。
(3)氯与氢之间的作用对全氮阴离子盐的稳定性起着至关重要的作用。结合原子结构解释氯元素非金属性强的原因:________。
【答案】 N5- 氯元素的结构示意图为
N5- 氯元素的结构示意图为 ,最外层得到1个电子,达到稳定结构
,最外层得到1个电子,达到稳定结构
【解析】
(1)氮元素位于第二周期VA族,根据核外电子排布规律进行分析;
(2)利用电荷守恒进行分析;
(3)利用氯原子的结构示意图进行分析;
(1)氮原子位于第二周期第VA族,氮的原子结构示意图为 ;
;
答案为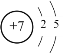 ;
;
(2) 构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+,根据全氮阴离子盐的化学式,以及呈现电中性,推出另外一种离子是N5-;
答案为N5-;
(3)氯元素的结构示意图为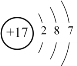 ,最外层得到1个电子,达到稳定结构,因此氯原子容易得到1个电子,表现出很强的非金属性;
,最外层得到1个电子,达到稳定结构,因此氯原子容易得到1个电子,表现出很强的非金属性;
答案为氯元素的结构示意图为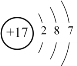 ,最外层得到1个电子,达到稳定结构。
,最外层得到1个电子,达到稳定结构。

【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
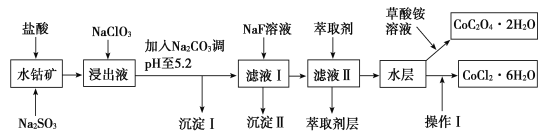
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Co(OH)2 | 7.6 | 9.2 |
Al(OH)3 | 4.0 | 5.2 |
Mn(OH)2 | 7.7 | 9.8 |
(1)浸出过程中氧化剂与还原剂物质的量之比为___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、___、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 150~210 | 290~320 |
固体质量/g | 4.41 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]