题目内容
5.门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是( )| A. | X单质不易与水反应 | B. | XO2可被碳或氢气还原为X | ||
| C. | XH4的稳定性比SiH4的高 | D. | XCl4的沸点比SiCl4的高 |
分析 根据硅元素对应的单质和化合物的性质进行判断,Si位于周期表第三周期,原子最外层有4个电子,性质较稳定,结合元素周期律的递变规律分析.
解答 解:A.X和Si的性质相似,和水不反应,故A正确;
B.X位于周期表第四周期,非金属性比Si弱,XO2可被碳或氢还原为X,故B正确;
C.X位于周期表第四周期,非金属性比Si弱,则XH4的稳定性比SiH4的低,故C错误;
D.XCl4的沸点比SiCl4的结构相似,形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,XCl4相对分子质量大,所以XCl4的沸点比SiCl4的高,故D正确.
故选:C.
点评 本题考查元素周期律的递变规律,题目难度不大,本题注意X和Si在周期表中的位置的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 | |
| D. | 增加X的物质的量,该反应的化学反应速率一定加快 |
16.化学反应是旧化学键断裂和新化学键形成的过程.氢气与氧气的反应中,破坏lmol氢氢键消耗的能量为Q1kJ、破坏1mol氧氧键消耗的能量为Q2kJ、形成lmol氢氧键释放的能量为Q3kJ.下列关系中正确的是( )
| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
20.下列说法中不正确的是( )
| A. | 化石燃料在燃烧过程中会产生污染环境的CO、SO2等有害气体 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效果好 | |
| C. | 太阳能、氢能、风能、核能、天然气等都属于新能源 | |
| D. | 水煤气是一种二次能源,比煤直接燃烧污染小 |
10.如图是CO2电催化还原为CH4的工作原理示意图.正确的是( )
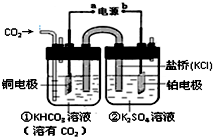

| A. | 该装置为原电池,其中a为正极 | |
| B. | 铜电极的电极反应式为:CO2+8H++8e-$?_{加热}^{催化剂}$CH4+2H2O | |
| C. | 反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 | |
| D. | 一段时间后,②池中溶液的pH一定下降 |
17.下列关于有机物的叙述不正确的是( )
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 能发生银镜反应的有机物都是醛 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 可用浓溴水来区分乙醇和苯酚 |
14.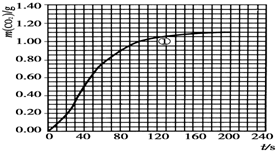 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)实验①中CO2质量随时间变化的关系见图:
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格 (粗、细)对该反应速率 的影响. |
| ② | ||||
| ③ | ||||
| ④ |
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
