题目内容
11.五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A. | 由Q与Y形成的化合物中只存在离子键 | |
| B. | Z与X之间形成的化合物具有还原性 | |
| C. | 由X、Y、Z三种元素形成的化合物,一定是共价化合物 | |
| D. | Y与W形成的化合物中,Y显负价 |
分析 短周期元素,只有W、Y、Z为同周期元素,由化合价可知,分别处于VIIA族、VIA族、VA族,X、Q的化合价均为+1价,处于IA族,结合原子半径知,X处于第一周期,W、Y、Z处于第二周期,Q处于第三周期,可推知X为H元素、W为F元素、Y为O元素、Z为N元素、Q为Na,据此解答.
解答 解:短周期元素,只有W、Y、Z为同周期元素,由化合价可知,分别处于VIIA族、VIA族、VA族,X、Q的化合价均为+1价,处于IA族,结合原子半径知,X处于第一周期,W、Y、Z处于第二周期,Q处于第三周期,可推知X为H元素、W为F元素、Y为O元素、Z为N元素、Q为Na.
A.由Q与Y形成的化合物有氧化钠、过氧化钠,前者含有离子键,后者含有离子键、共价键,故A错误;
B.Z与X之间形成的化合物为氨气等,氨气中N元素处于最低价,具有还原性,故B正确;
C.由X、Y、Z三种元素形成的化合物有硝酸、硝酸铵等,硝酸属于共价化合物,而硝酸铵属于离子化合物,故C错误;
D.Y为O元素、W为F元素,由于F的电负性大于O,二者形成的化合物中F显负价,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,难度中等,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握,D选项注意根据电负性理解.

练习册系列答案
相关题目
1.现有反应4NH3+5O2═4NO+6H2O,反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,其关系正确的是( )
| A. | 4v(NH3)=5(O2) | B. | 4 v(NH3)=6 v(H2O) | C. | 4v(O2)=5 v(NO) | D. | 4 v(NH3)=5 v(NO) |
2.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | υ(A)=0.5 mol•(L•s)-1 | B. | υ(B)=0.3 mol•(L•s)-1 | ||
| C. | υ(C)=0.8 mol•(L•s)-1 | D. | υ(D)=1 mol•(L•s)-1 |
19.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O.下列有关锌-锰干电池的叙述中,正确的是( )
| A. | 干电池中锌筒为正极,石墨棒为负极 | |
| B. | 干电池长时间连续工作后,糊状物可能流出,腐蚀用电器 | |
| C. | 干电池工作时,电流方向是由锌筒经外电路流向石墨棒 | |
| D. | 干电池可实现化学能向电能和电能向化学能的相互转化 |
6.下列溶液中NO3-的物质的量最大的是( )
| A. | 500mL1mol/L的KNO3溶液 | B. | 500mL1mol/L的Ba(NO3)2溶液 | ||
| C. | 100mL0.5mol/L的Mg(NO3)2溶液 | D. | 1L0.5mol/L的Fe(NO3)3溶液 |
16.化学反应是旧化学键断裂和新化学键形成的过程.氢气与氧气的反应中,破坏lmol氢氢键消耗的能量为Q1kJ、破坏1mol氧氧键消耗的能量为Q2kJ、形成lmol氢氧键释放的能量为Q3kJ.下列关系中正确的是( )
| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
3.气体甲能使湿润的红色石蕊试纸变蓝,气体乙可在空气中产生白雾,当甲与乙相遇时可能生成( )
| A. | NH4C1 | B. | NH4HCO3 | C. | (NH4)2CO3 | D. | (NH4)2SO4 |
20.下列说法中不正确的是( )
| A. | 化石燃料在燃烧过程中会产生污染环境的CO、SO2等有害气体 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效果好 | |
| C. | 太阳能、氢能、风能、核能、天然气等都属于新能源 | |
| D. | 水煤气是一种二次能源,比煤直接燃烧污染小 |
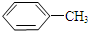 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$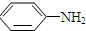

 ,G
,G .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. 与碳酸氢钠溶液反应:
与碳酸氢钠溶液反应: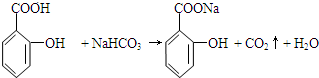 .
.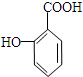 有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.
有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.