题目内容
【题目】工业合成氨对人类生存贡献巨大,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__。
(2)平衡后,若提高H2的转化率,可以采取的措施有__。
A.加入催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
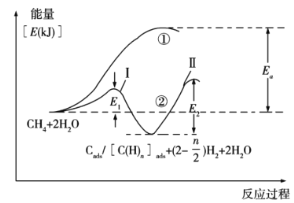
(3)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中的部分微粒)。
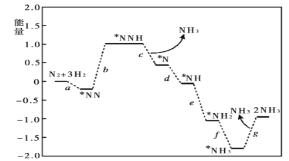
写出步骤c的化学方程式___;由图像可知合成氨反应的△H__0(填“>”“<”或“=”)。
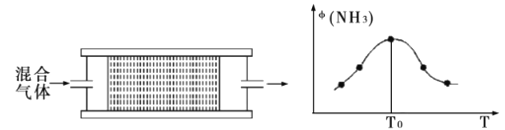
(4)将n(N2)∶n(H2)=1∶3的混合气体,匀速通过装有催化剂的刚性反应器,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图。随着反应器温度升高,NH3的体积分数φ(NH3)先增大后减小的原因是_。
某温度下,混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则H2的转化率为___(气体分压P分=P总×体积分数)。用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作KP),此温度下,该反应的化学平衡常数KP=__(分压列计算式、不化简)。
(5)合成氨的原料气H2可来自甲烷水蒸气催化重整(SMR)。我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2-![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/C(H)n]ads+2H2O→CO2+(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/C(H)n]ads+2H2O→CO2+(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①__②(填“>”“<”或“=”);控制整个过程②反应速率的是第__步(填“I”或“II”),其原因为__。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①__②(填“>”“<”或“=”);控制整个过程②反应速率的是第__步(填“I”或“II”),其原因为__。
【答案】0.01molL-1min-1 CD NNH+H2![]() N+NH3 < 温度低于To时未达平衡,温度升高,反应速率加快,NH3的体积分数增大;高于To时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小(答案合理即可) 20%
N+NH3 < 温度低于To时未达平衡,温度升高,反应速率加快,NH3的体积分数增大;高于To时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小(答案合理即可) 20% ![]() = Ⅱ 第Ⅱ步的活化能大,反应速率慢
= Ⅱ 第Ⅱ步的活化能大,反应速率慢
【解析】
![]()
![]() (1)对于合成氨反应N2(g)+3H2(g)
(1)对于合成氨反应N2(g)+3H2(g)![]() 2NH3(g),由平衡时生成NH3的物质的量为0.2mol,可求出参加反应的N2为0.1mol,由此可求出在一容积为2L的密闭容器中,前5分钟的平均反应速率v(N2)。
2NH3(g),由平衡时生成NH3的物质的量为0.2mol,可求出参加反应的N2为0.1mol,由此可求出在一容积为2L的密闭容器中,前5分钟的平均反应速率v(N2)。
(2)A.加入催化剂,可加快反应速率,但对平衡不产生影响;
B.增大容器体积,也就是减小压强,平衡逆向移动;
C.降低反应体系的温度,平衡正向移动;
D.加入一定量N2,平衡正向移动。
(3)由图中可以看出,步骤c中NNH与H2在催化剂作用下发生反应生成N和NH3;由图象可知合成氨反应的反应物总能量大于生成物的总能量。
(4)对于放热反应,升高温度平衡逆向移动,To前,随温度升高,NH3的体积分数φ(NH3)增大,则表明反应未达平衡,由此得出先增大后减小的原因。
令起始时,n(N2)=1mol,则n(H2)=3mol,设参加反应的N2的物质的量为x,从而建立三段式:
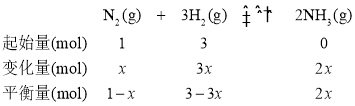
则![]() ,由此可求出x=0.2mol,从而确定H2的转化率。则平衡分压p(N2)=
,由此可求出x=0.2mol,从而确定H2的转化率。则平衡分压p(N2)=![]() =4×106pa,p(H2)=
=4×106pa,p(H2)=![]() =1.2×107pa,p(NH3)=
=1.2×107pa,p(NH3)=![]() =2×106pa,代入KP即得。
=2×106pa,代入KP即得。
(5)过程①和②中,催化剂不影响反应物的转化率,对ΔH不产生影响;整个过程②分两步进行,第二步的活化能大。
(1)对于合成氨反应N2(g)+3H2(g)![]() 2NH3(g),由平衡时生成NH3的物质的量为0.2mol,可求出参加反应的N2为0.1mol,由此可求出在一容积为2L的密闭容器中,前5分钟的平均反应速率v(N2)=
2NH3(g),由平衡时生成NH3的物质的量为0.2mol,可求出参加反应的N2为0.1mol,由此可求出在一容积为2L的密闭容器中,前5分钟的平均反应速率v(N2)=![]() = 0.01molL-1min-1。答案为:0.01molL-1min-1;
= 0.01molL-1min-1。答案为:0.01molL-1min-1;
(2)A.加入催化剂,可加快反应速率,但对平衡不产生影响,A不合题意;
B.增大容器体积,也就是减小压强,平衡逆向移动,H2的转化率减小,B不合题意;
C.降低反应体系的温度,平衡正向移动,H2的转化率增大,C符合题意;
D.加入一定量N2,平衡正向移动,H2的转化率增大,D符合题意;
故选CD。答案为:CD;
(3)由图中可以看出,步骤c中NNH与H2在催化剂作用下发生反应生成N和NH3,步骤c的反应方程式为NNH+H2![]() N+NH3;由图象可知合成氨反应的反应物总能量大于生成物的总能量,所以合成氨反应的△H<0。答案为:NNH+H2
N+NH3;由图象可知合成氨反应的反应物总能量大于生成物的总能量,所以合成氨反应的△H<0。答案为:NNH+H2![]() N+NH3;<;
N+NH3;<;
(4)对于放热反应,升高温度平衡逆向移动,To前,随温度升高,NH3的体积分数φ(NH3)增大,则表明反应未达平衡,由此得出先增大后减小的原因为温度低于To时未达平衡,温度升高,反应速率加快,NH3的体积分数增大;高于To时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小(答案合理即可)。答案为:温度低于To时未达平衡,温度升高,反应速率加快,NH3的体积分数增大;高于To时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小(答案合理即可);
令起始时,n(N2)=1mol,则n(H2)=3mol,设参加反应的N2的物质的量为x,从而建立三段式:
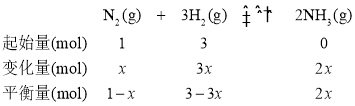
则![]() ,由此可求出x=0.2mol,从而确定H2的转化率为
,由此可求出x=0.2mol,从而确定H2的转化率为![]() =20%;平衡分压p(N2)=
=20%;平衡分压p(N2)=![]() =4×106pa,p(H2)=
=4×106pa,p(H2)=![]() =1.2×107pa,p(NH3)=
=1.2×107pa,p(NH3)=![]() =2×106pa,代入,即得KP=
=2×106pa,代入,即得KP=![]() 。答案为:20%;
。答案为:20%;![]() ;
;
(5)过程①和②中,催化剂不影响反应物的转化率,对ΔH不产生影响,所以①=②;整个过程②分两步进行,第II步的活化能大,所以需控制第II步,其原因为第Ⅱ步的活化能大,反应速率慢。答案为:=;Ⅱ;第Ⅱ步的活化能大,反应速率慢。

【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
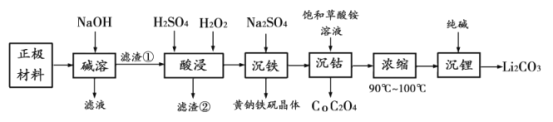
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
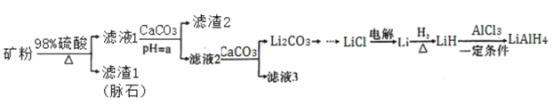
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________、加热;加入CaCO3的作用是_____,“a”的最小值为______________。
(2)写出LiH和AlC13反应的化学方程式为_____________(条件不作要求)。
(3)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是_______________。
(4)四氢铝锂LiAlH4溶解于NaOH溶液后得到无色透明溶液,并产生一种无色气体。请写出该反应的离子方程式_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为________________(结果保留2位小数)。