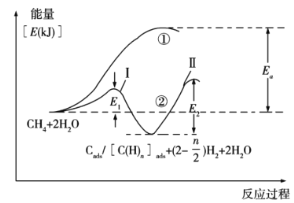
题目内容
【题目】有研究预测,到2030年,全球报废的电池将达到1100万吨以上。而目前废旧电池的回收率却很低。为了提高金属资源的利用率,减少环境污染,应该大力倡导回收处理废旧电池。下面是一种从废电池正极材料(含铝箔、LiCoO2、Fe2O3及少量不溶于酸碱的导电剂)中回收各种金属的工艺流程:
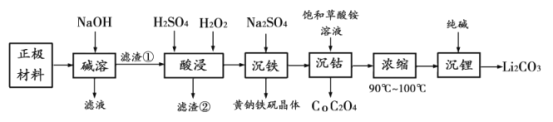
资料:1.黄钠铁矾晶体颗粒粗大,沉淀速度快,易于过滤。
2.钴酸锂难溶于水、碳酸锂的溶解度随温度升高而降低。
回答下列问题:
(1)为了提高碱溶效率可以__,__。(任答两种)
(2)从经济效益的角度考虑,为处理“碱溶”后所得滤液,可向其中通入过量CO2,请写出所发生反应的化学反应方程式__。
(3) “酸浸”时有无色气体产生,写出发生反应的离子方程式__。
(4) “沉铁”时采用的“黄钠铁矾法”与传统的通过调整溶液pH的“氢氧化物沉淀法”相比,金属离子的损失少,请分析并说明原因:___。
(5) “沉锂”后得到碳酸锂固体的实验操作为__。
(6)已知黄钠铁矾的化学式为NaxFey(SO4)m(OH)n。为测定黄钠铁矾的组成,进行了如下实验:①称取4.850g样品,加盐酸完全溶解后,配成100.00mL溶液;②量取25.00mL溶液,加入足量的KI,用0.2500molL-1Na2S2O3溶液进行滴定(反应2Fe3++2I-=2Fe2++I2,I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mLNa2S2O3溶液至终点。③另取25.00mL溶液,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
用Na2S2O3溶液进行滴定时,使用的指示剂为__;计算出黄钠铁矾的化学式__。
【答案】将正极材料粉碎 搅拌、适当升高温度等(任答两种) Na[Al(OH)4]+CO2==Al(OH)3↓+NaHCO3(或其他合理答案) 2LiCoO2+6H++H2O2==2Li++2Co2++O2↑+4H2O 调节pH时Fe3+会形成Fe(OH)3胶体,吸附溶液中的金属阳离子 趁热过滤 淀粉溶液 NaFe3(SO4)2(OH)6
【解析】
正极材料(含铝箔、LiCoO2、Fe2O3及少量不溶于酸碱的导电剂)加入NaOH碱溶后,铝箔溶解成为滤液,此时滤渣为LiCoO2、Fe2O3及少量不溶于酸碱的导电剂;加入H2SO4、H2O2酸浸后,LiCoO2、Fe2O3溶解生成Li+、Co2+(酸溶时生成的Co3+被H2O2还原为Co2+),不溶于酸碱的导电剂成为滤渣;加入Na2SO4后,Fe3+转化为黄钠铁矾沉淀;加入草酸铵饱和溶液后,Co2+转化为CoC2O4沉淀;溶液浓缩后,加入纯碱,Li+转化为Li2CO3沉淀。
(1)为了提高碱溶效率,可以通过增大接触面积、升高温度等操作实现,具体操作为将正极材料粉碎,搅拌、适当升高温度等(任答两种)。答案为:将正极材料粉碎;搅拌、适当升高温度等(任答两种);
(2)为处理“碱溶”后所得滤液中含有的Na[Al(OH)4],向其中通入过量CO2,生成Al(OH)3沉淀和NaHCO3,发生反应的化学反应方程式为Na[Al(OH)4]+CO2==Al(OH)3↓+NaHCO3。答案为:Na[Al(OH)4]+CO2==Al(OH)3↓+NaHCO3(或其他合理答案);
(3) “酸浸”时,LiCoO2溶解生成Li+、Co2+(酸溶时生成的Co3+被H2O2还原为Co2+),同时生成O2,发生反应的离子方程式为2LiCoO2+6H++H2O2==2Li++2Co2++O2↑+4H2O。答案为:2LiCoO2+6H++H2O2==2Li++2Co2++O2↑+4H2O;
(4) “沉铁”时采用的“黄钠铁矾法”与传统的通过调整溶液pH的“氢氧化物沉淀法”相比,后者生成的Fe(OH)3胶体具有吸附作用,能吸附溶液中的金属离子,从而造成离子损失,原因是:调节pH时Fe3+会形成Fe(OH)3胶体,吸附溶液中的金属阳离子。答案为:调节pH时Fe3+会形成Fe(OH)3胶体,吸附溶液中的金属阳离子;
(5)信息显示,碳酸锂的溶解度随温度升高而降低,由此得出“沉锂”后得到碳酸锂固体的实验操作为趁热过滤。答案为:趁热过滤;
(6)在配成的100.00mL溶液中,依据关系式2Fe3+——I2——2 Na2S2O3,可求出n(Fe3+)=0.2500molL-1×0.030L×4=0.03mol,n(SO42-)=![]() =0.02mol,则
=0.02mol,则
23n(Na+)+17n(OH-)+0.03×56+0.02×96=4.85(质量守恒)
0.03×3+ n(Na+)=0.02×2+ n(OH-) (电荷守恒)
从而求出n(Na+)=0.01mol,n(OH-)=0.06mol,n(Na+):n(Fe3+):n(SO42-):n(OH-)=1:3:2:6,用Na2S2O3溶液进行滴定时,使用的指示剂为淀粉溶液;根据上面计算出的比值,可确定黄钠铁矾的化学式为NaFe3(SO4)2(OH)6。答案为:淀粉溶液;NaFe3(SO4)2(OH)6。

 名校课堂系列答案
名校课堂系列答案【题目】下列编号代表元素周期表中的一部分元素,用化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ | ⑧ | |||||
三 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
四 | ② | ④ |
(1)①、③、⑤的最高价氧化物的水化物碱性由强到弱顺序为___________(填化学式,下同)。
(2)②、③、④形成的简单阳离子半径由大到小的顺序是______________。
(3)⑨和⑩的最高价氧化物对应的水化物化学式为_______和_________。①在氧气中点燃生成淡黄色的固体,该固体的电子式为_______________,①能够与水剧烈反应,请写出该反应的化学方程式_______________,将元素⑩的单质通入NaBr溶液中,反应的离子方程式为_______________。
(4)⑥、⑦、⑧三种元素形成的气态氢化物的稳定性排序是____________(填化学式,下同),三种元素非金属性由强到弱的顺序为___________。
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应