题目内容
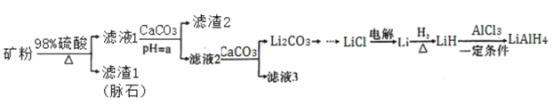
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有________________、加热;加入CaCO3的作用是_____,“a”的最小值为______________。
(2)写出LiH和AlC13反应的化学方程式为_____________(条件不作要求)。
(3)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是_______________。
(4)四氢铝锂LiAlH4溶解于NaOH溶液后得到无色透明溶液,并产生一种无色气体。请写出该反应的离子方程式_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为________________(结果保留2位小数)。
【答案】粉碎矿石(或提高硫酸浓度、搅拌) 调节溶液的pH使Al3+、Fe3+转化为氢氧化物 6.5 ![]() 减少碳酸锂的损失
减少碳酸锂的损失 ![]() 0.21
0.21
【解析】
以辉锂矿(主要成分是Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂,矿粉中加入浓硫酸并加热反应,然后过滤,得到的滤渣1为脉石,滤液1中含有硫酸铁、硫酸铝、硫酸锂和硫酸,向滤液1中加入碳酸钙,碳酸钙和氢离子反应从而调节溶液的pH,使溶液中铁离子、铝离子转化为沉淀,滤液2中含有硫酸锂和硫酸钙,向滤液2中加入碳酸钙,得到碳酸锂沉淀和滤液3,电解氯化锂得到Li,Li和氢气化合得到LiH,LiH和氯化铝在一定条件下反应生成LiAlH4,据此解答。
(1)上述流程中,提高“酸浸”速率的措施有粉碎矿石、提高硫酸浓度、搅拌、加热等措施;加入碳酸钙可中和溶液中的酸,使Al3+、Fe3+完全生成氢氧化铝、氢氧化铁沉淀,从而除去,从表格数据可以看出,调节pH最小值为6.5,可确保两种离子完全沉淀,故答案为:粉碎矿石(或提高硫酸浓度、搅拌);调节溶液的pH使Al3+、Fe3+转化成氢氧化物;6.5;
(2)氯化铝与氢化锂反应生成四氢铝锂和氯化锂,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)依题意,碳酸锂的溶解度随温度升高而减小,用热水洗涤碳酸锂,可以减少碳酸锂损失,故答案为:减少碳酸锂的损失;
(4)四氢铝锂LiAlH4溶解于NaOH溶液后得到无色透明溶液,碱性环境铝元素转化为偏铝酸根离子,并产生一种无色气体为氢气,氢元素的化合价由-1价和+1价变为0价,发生归中反应,反应的离子方程式为:![]() 故答案为:
故答案为:![]() ;
;
(5)由题给信息可知,还原剂的还原能力实指失电子数,1mol LiAlH4能提供8mol电子,相当于4mol H2,LiAH4的有效氢![]() ,故答案为:0.21。
,故答案为:0.21。

【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。