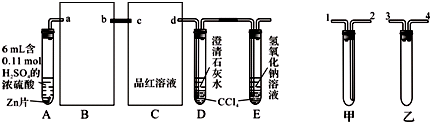
题目内容
13.硒是与硫同主族的元素.已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
(1)通过以上反应判断SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2.
工业上回收得到的SeO2样品混有其它杂质,可以通过下面的方法测定SeO2含量:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
(2)配平反应式①,标出电子转移的方向和数目
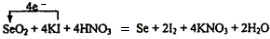 .
.(3)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为92.5%.
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(4)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是H2SO4溶液;各取5mL上述溶液,分别加热(温度相同),pH较小的是NH4Cl溶液.
(5)取5mL NH4Cl溶液,加水稀释至50mL,c(H+)>10-6mol/L(填“>”、“<”或“=”),$\frac{c(N{H}_{4}^{+})}{c({H}^{+})}$减小(填“增大”、“减小”或“不变”).
(6)向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸.
①在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为c(选填字母).
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-) b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]d.2c(Na+)=c(H2S)+c(HS-)+2c(S2-)
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-=CuS↓+H+(用离子方程式表示).
分析 (1)Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O中Se元素化合价升高,S元素的化合价降低;2SO2+SeO2+2H2O→Se+2SO42-+4H+中Se元素的化合价降低、S元素的化合价升高,结合氧化剂的氧化性大于氧化产物的氧化性分析;
(2)反应①中I-失去电子生成I2,共升高2价,SeO2中+4价Se得到单质还原为单质Se,共降低4价,结合电子守恒、原子守恒分析;
(3)根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=cV计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=nM计算SeO2的质量,进而计算样品中SeO2的质量分数;
(4)强酸溶液稀释,氢离子浓度随体积变化减小,氯化铵溶液稀释除随体积变化浓度减小外,稀释促进铵根离子的水解,氢离子浓度增大;
氯化铵水解过程是吸热反应,加热溶液,促进水解氢离子浓度变大,硫酸溶液加热,氢离子浓度基本不变;
(5)加水促进氯化铵水解,生成氢离子的物质的量增大,溶液中体积相同,离子浓度之比等于离子物质的量之比;
(6)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合物料守恒分析;
②恰好完全反应,所得溶液呈强酸性,则生成CuS和硫酸、硫酸钠.
解答 解(1)Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O中Se元素化合价升高,S元素的化合价降低;2SO2+SeO2+2H2O→Se+2SO42-+4H+中Se元素的化合价降低、S元素的化合价升高,由氧化剂的氧化性强于氧化产物的氧化性可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2,
故答案为:H2SO4(浓)>SeO2>SO2;
(2)反应①中I-失去电子生成I2,共升高2价,SeO2中+4价Se得到单质还原为单质Se,共降低4价,化合价升降最小公倍数为4,故KI的系数为4,I2的系数为2,SeO2、Se的系数都是1,KNO3的系数为4,H2O的系数为2,配平并标出电子转移的方向和数目为: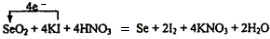 ,
,
故答案为: ;
;
(3)根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.025L=0.005mol,根据关系式计算样品中n(SeO2)=0.005mol×$\frac{1}{4}$=0.00125mol,故SeO2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为$\frac{0.13875g}{0.1500g}$×100%=92.5%,故答案为:92.5%;
(4)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加水稀释至50mL,稀释10倍,硫酸溶液pH变化为6,氯化铵铵根离子水解促进,溶液中氢离子浓度减小的少,溶液pH小于6,则pH较大的是硫酸溶液;
室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加热(温度相同),硫酸溶液中氢离子浓度变化不大,氯化铵溶液中水解是系热热反应,加热促进水解,氢离子浓度增大,溶液pH较小的是NH4Cl氯化铵溶液;
故答案为:H2SO4;NH4Cl;
(5)取5mL NH4Cl溶液,加水稀释至50mL,体积变化氢离子浓度减小10倍,稀释促进水解平衡,所以溶液中氢离子浓度大于10-6,但小于10-5;铵根离子水解平衡NH4++H2O?NH3•H2O+H+;稀释会得到促进,溶液中的铵根离子减小,氢离子增多,则$\frac{c(N{H}_{4}^{+})}{c({H}^{+})}$ 减小,
故答案为:>; 减小;
(6)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,含硫微粒浓度减小为S2-,先增加后减少为HS-,浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],故答案为:c;
②恰好完全反应,所得溶液呈强酸性,则生成CuS和硫酸、硫酸钠,发生的离子反应为Cu2++HS-=CuS↓+H+,故答案为:Cu2++HS-=CuS↓+H+.
点评 本题考查较综合,涉及物质含量的测定、氧化还原反应、溶液中离子浓度比较、盐类水解及应用等,综合性较强,题目难度中等,侧重分析与应用能力的综合考查.

| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| 选项 | 目 的 | 操作或现象 |
| A | 制备无水FeCl3 | 将FeCl3溶液加热蒸干 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 证明非金属性Cl>C>Si | 向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D | 测定NaCl中混有Na2CO3的量 | 取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用饱和硫酸铵溶液沉淀蛋白质 | |
| B. | 用生石灰干燥氨气 | |
| C. | 用铝制的容器盛装浓硫酸 | |
| D. | 用饱和碳酸钠溶液收集实验室制取的乙酸乙酯 |
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或 最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素②⑥形成的化合物具有两性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素⑤对应的离子半径大于元素⑦对应的离子半径 | |
| D. | 元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
| A. | 二氧化碳气体通入紫色石蕊试液中,溶液变蓝 | |
| B. | 将燃着的木条伸入集气瓶,火焰立即熄灭,证明瓶内原有气体就是二氧化碳 | |
| C. | 用块状石灰石和稀硫酸迅速制备大量二氧化碳 | |
| D. | 干冰用于人工降雨 |