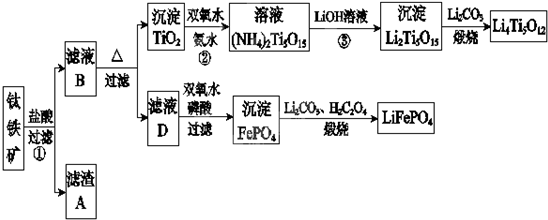
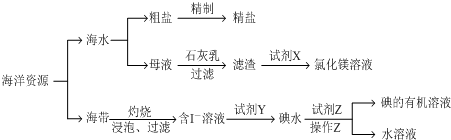
题目内容
18.将下列物质进行分类:①11H 与13H ②O2 与O3 ③H2O与 D2O ④C60 与C70⑤CH3CH2CH2CH3 与CH3CH2CH3 ⑥乙醇(C2H5OH)与甲醚(CH3-O-CH3)(1)互为同位素的是①(填编号,下同);
(2)互为同素异形体的是②④;
(3)互为同分异构体的是⑥.
分析 具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;同素异形体是同种元素形成的不同单质;具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:(1)①11H 与13H具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,故答案为:①;
(2)②O2 与O3④C60 与C70 是同种元素形成的不同单质,故答案为:②④;
(3)乙醇(C2H5OH)与甲醚(CH3-O-CH3)具有相同分子式而结构不同,互为同分异构体.故答案为:⑥.
点评 本体考查同位素,同分异构体,同素异形体的定义,难度不大,注意对概念的理解.

练习册系列答案
相关题目
8.关于下列装置说法正确的是( )
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. |  工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. |  工作时,c极为发生氧化反应 | |
| D. | 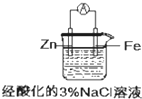 电子由Zn流向Fe,装置中有Fe2+生成 |
3.氯水中存在如下平衡:Cl2(g)?Cl2(aq)、Cl2(aq)+H2O?H++Cl-+HClO.下列说法正确的是( )
| A. | 向饱和氯水中通入HCl,有c(H+)═c(Cl-)+c(OH-)+c(ClO-) | |
| B. | 氯气在1mol•L-1的NaCl溶液中比在1mol•L-1的AlCl3溶液中的溶解度小 | |
| C. | 光照,氯水的漂白性增强 | |
| D. | 若向饱和氯水中通入少量H2S,则$\frac{c({H}^{+})}{c(ClO^-)}$减小 |
1.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
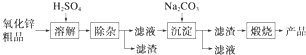
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO4 2-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO4 2-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
18.已知氯化银、溴化银的溶解度分别是1.5×10-4g和8.4×10-6g,将氯化银和溴化银的饱和溶液等体积混合,再加入足量浓硝酸银溶液,则发生的反应为( )
| A. | 只有溴化银沉淀生成 | B. | 氯化银河溴化银沉淀等量生成 | ||
| C. | 氯化银沉淀多于溴化银沉淀 | D. | 氯化银沉淀少于溴化银沉淀 |
19.下列叙述错误的是( )
| A. | 任何可逆反应都有一定的反应限度 | B. | 反应达到限度即停止了 | ||
| C. | 化学反应限度与时间的长短无关 | D. | 化学反应限度是可以改变的 |