题目内容
1.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下: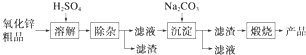
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO4 2-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
分析 制备活性氧化锌流程为:氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)中加入稀硫酸,氧化锌、铁的氧化物、氧化铜与稀硫酸反应,二氧化硅不反应,通过过滤操作分离出二氧化硅,滤液中含有铁离子、亚铁离子、锌离子、铜离子,酸化滤液后加入适量碳酸钠溶液得到沉淀ZnCO3•2Zn(OH)2•H2O,经过煅烧得到ZnO,
(1)根据增大接触面积可以加快反应的速率分析回答;×
(2)根据溶液酸碱度的变化、化合价的变化分析判断回答;
(3)根据锌能置换出溶液中的铜分析回答;
(4)根据“煅烧”ZnCO3•2Zn(OH)2•H2O的反应写出反应的化学方程式.
解答 解:(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大接触面积,加快反应速率.
故答案为:增大固液接触面积,加快溶解时的反应速率;
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3 调节溶液的pH至5.4,使溶液的酸性减弱,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.在KMnO4中锰元素的化合价降低,该反应中作为氧化剂.调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.反应的离子方程式为:
MnO4 -+3Fe2++7H2O=MnO2+3Fe(OH)3↓+5H+
1 3
n 1L×0.009mol•L-1
n=0.003mol,
故答案为:0.003;
(3)由于制备活性氧化锌,杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉,
故答案为:锌粉;
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为 ZnCO3•2Zn(OH)2•H2O 3ZnO+CO2↑+3H2O↑.
故答案为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
点评 本题考查了物质的制备、分离和提纯方法的综合应用,难度较大,应注意加强基础知识的学习和应用知识解决问题的能力的提高.

 阅读快车系列答案
阅读快车系列答案| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
(1)上述正反应方向是放热反应(填“放热”或“吸热”).
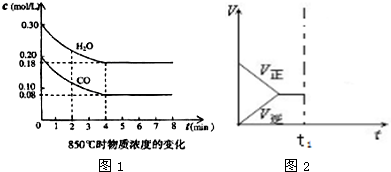
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如图1,则0~4min的平均反应速率v(CO)=0.03mol/(L•min)
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(4)t1(℃高于850)℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
①表中3min~4min之间反应处于平衡状态;理由是反应在3min和4min时的各物质浓度相同.
②表中5min~6min之间数值发生变化,可能的原因是A(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为75%.
(6)若在500℃时该反应达到了平衡状态,此时体系中的v-t图象如图2所示,若在t1时给体系适当升高温度,则v-t图象也会随之发生变化,请把v-t图补充画全(需标明正方向的反应速率和逆方向的反应速率).
| A. | c(H+)=1×10-13 mol•L-1的溶液中:Na+、Mg2+、I-、SO42- | |
| B. | 0.1mol•L-1的明矾溶液中:K+、NH4+、Cl-、HCO3- | |
| C. | pH=1的溶液中:Na+、NH4+、MnO4-、S2O32- | |
| D. | 无色透明的溶液中:Na+、Ba2+、Br-、NO3- |
| A. | 单质的氧化性 | B. | 得电子能力 | C. | 氢化物的稳定性 | D. | 原子半径 |
Ⅰ.合成苯甲酸甲酯粗产品
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
(1)该反应中浓硫酸的作用,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:C6H5CO18OH+CH3OH催化剂加热$?_{△}^{催化剂}$H5COOCH3+H218O,甲醇过量的原因该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高产率.
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是冷却后补加.
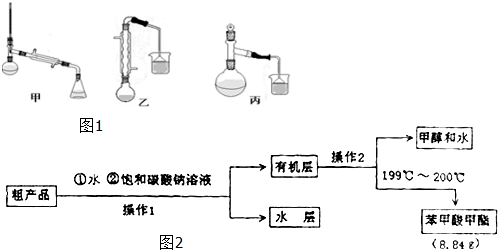
(3)甲、乙、丙三位同学分别设计了如图1三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的特点,最好采用装置乙(填“甲”、“乙”、“丙”).
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用图2流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为,操作Ⅱ为分液,蒸馏.
(5)如图2流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是将分液漏斗上口的玻璃塞打开(或使塞上的凹槽对准漏斗口上的小孔),再旋开分液漏斗活塞,用锥形瓶接收下层液体,待下层液体刚好流尽时关闭活塞,将有机层从分液漏斗上口倒入另一干净的容器(或烧杯)中.
(6)苯甲酸甲酯的产率为65%.
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
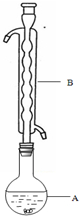
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管.其作用是冷凝回流.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)步骤④应采取的操作是蒸发浓缩、冷却结晶.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.如果滤液中该杂质的含量不很低,其检测的方法是:取出少许溶液,加稀盐酸至酸性,静置后,取上层清液或过滤除去S,再加BaCl2溶液,若出现浑浊则含Na2SO4,反之不含.
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 可用过滤的方法将黑色金属氧化物与Na+分离开 |