题目内容
6.有关海洋中部分资源的利用如图所示,回答下列问题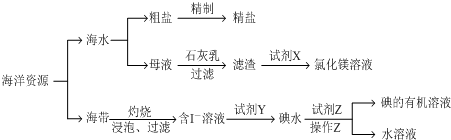
(1)粗盐中除含有泥砂等不溶性杂质外,还含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子.
①除去杂质离子所用试剂的按顺序依次是NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH或BaCl2、NaOH、Na2CO3(填试剂的化学式),过滤后向滤液中加入适量盐酸,蒸发结晶得精盐.
②检验所得精盐中是否含有SO42-的操作是取少量精盐溶解,向溶液中滴加BaCl2溶液,若无沉淀生成,则精盐中不含有SO42-.
(2)母液中含有较多的Mg2+,利用流程所示方法可以制取氯化镁溶液,滤渣中加入试剂X的离子反应方程式为Mg(OH)2+2H+=2Mg2++2H2O.
(3)含I-溶液中加入试剂Y的目的是将I-氧化(填“氧化”或“还原”)成I2.
(4)试剂Z可以用苯或CCl4,操作Z的名称是萃取、分液,所需主要玻璃仪器的名称是分液漏斗、烧杯.
分析 海洋资源中的海水晒盐得到粗盐,除杂得到精盐,母液中加入氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀中加入盐酸溶解得到氯化镁溶液,海带灼烧浸泡,过滤得到含碘离子的溶液,加入氧化剂氯水氧化碘离子为碘单质,加入有机萃取剂萃取碘单质,得到碘单质的有机溶液,
(1)①在粗盐提纯的过程中需要滴加量NaOH溶液、BaCl2溶液和Na2CO3溶液除去镁离子、硫酸根和钙离子以及过量的钡离子;
②加入氯化钡溶液检验硫酸根离子是否除尽;
(2)流程中是利用氢氧化钙测定镁离子,过滤得到氢氧化镁溶解于盐酸形成氯化镁溶液,滤渣中加入试剂X是溶解氢氧化镁得到氯化镁溶液;
(3)试剂Y是氧化剂,氧化碘离子为单质碘;
(4)试剂Z为有机萃取剂,萃取碘单质,需要的仪器是烧杯、玻璃棒、分液漏斗等.
解答 解:(1)①在粗盐提纯的过程中需要滴加量NaOH溶液、BaCl2溶液和Na2CO3溶液目的是分别除去Mg2+、SO42-和Ca2+以及的Ba2+,由于加入Na2CO3溶液的目的是除去Ca2+和过量的Ba2+,反应离子方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl,依次加入试剂的顺序为:NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH或BaCl2、NaOH、Na2CO3,
故答案为:NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH或BaCl2、NaOH、Na2CO3;
②加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽;检验所得精盐中是否含有SO42-的操作是:取少量精盐溶解,向溶液中滴加BaCl2溶液,若无沉淀生成,则精盐中不含有SO42-.
故答案为:取少量精盐溶解,向溶液中滴加BaCl2溶液,若无沉淀生成,则精盐中不含有SO42-;
(2)流程中是利用氢氧化钙测定镁离子,过滤得到氢氧化镁溶解于盐酸形成氯化镁溶液,滤渣中加入试剂X是溶解氢氧化镁得到氯化镁溶液反应的离子方程式为,Mg(OH)2+2H+=2Mg2++2H2O,
故答案为:Mg(OH)2+2H+=2Mg2++2H2O;
(3)试剂Y是氧化剂,含I-溶液中加入试剂Y的目的是将I-氧化为单质碘,
故答案为:氧化;
(4)试剂Z为有机萃取剂苯或CCl4 等,试剂和水溶液互不相溶,碘单质在有机溶剂中溶解度大,可以萃取碘单质,需要的仪器是烧杯、玻璃棒、分液漏斗等,
故答案为:苯或CCl4; 萃取、分液;分液漏斗(烧杯).
点评 本题考查了海水资源的利用,物质制备方法除杂步骤和试剂的选择,掌握基础是关键,题目难度中等.

| A. | Fe、Cu元素在白然界中主要以化合态形式存在 | |
| B. | CO在高温下能将Fe203还原为Fe | |
| C. | Fe与盐酸、Fe与Cl2发生反应均生成FeCl3 | |
| D. | 制作印刷电路板时,可用FeCl3溶液腐蚀Cu |
| A. | 碘的萃取 | B. | 电解食盐水 | C. | 葡萄酿酒 | D. | 金属冶炼 |
| A. | c(H+)=1×10-13 mol•L-1的溶液中:Na+、Mg2+、I-、SO42- | |
| B. | 0.1mol•L-1的明矾溶液中:K+、NH4+、Cl-、HCO3- | |
| C. | pH=1的溶液中:Na+、NH4+、MnO4-、S2O32- | |
| D. | 无色透明的溶液中:Na+、Ba2+、Br-、NO3- |
| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | 在其他外界条件不变的情况下,使用催化剂可改变化学反应进行的方向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2 (g)△H=+185.57 kJ/mol可能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
Ⅰ.合成苯甲酸甲酯粗产品
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
(1)该反应中浓硫酸的作用,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:C6H5CO18OH+CH3OH催化剂加热$?_{△}^{催化剂}$H5COOCH3+H218O,甲醇过量的原因该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高产率.
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是冷却后补加.
(3)甲、乙、丙三位同学分别设计了如图1三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的特点,最好采用装置乙(填“甲”、“乙”、“丙”).
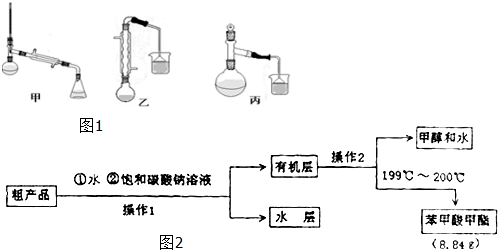
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用图2流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为,操作Ⅱ为分液,蒸馏.
(5)如图2流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是将分液漏斗上口的玻璃塞打开(或使塞上的凹槽对准漏斗口上的小孔),再旋开分液漏斗活塞,用锥形瓶接收下层液体,待下层液体刚好流尽时关闭活塞,将有机层从分液漏斗上口倒入另一干净的容器(或烧杯)中.
(6)苯甲酸甲酯的产率为65%.
| A. | CH3-CH=CH2与HCl发生加成反应 | |
| B. | CH3-CH2-CH2-Br在强碱的水溶液中发生水解反应 | |
| C. | 甲苯在铁粉作催化剂的条件下与氯气反应 | |
| D. | CH3-CHCl-CH2-CH3与NaOH醇溶液共热 |