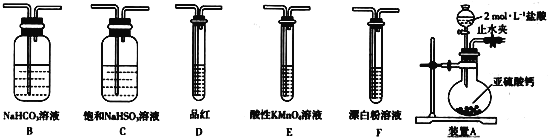
题目内容
【题目】根据杂化轨道理论判断下列分子的空间构型是V形的是( )
A. BeCl2B. H2OC. HCHOD. CS2
【答案】B
【解析】
A.BeCl2分子中,铍原子含有两个共价单键,不含孤电子对,分子的立体构型为直线形,故A错误;
B.水分子中孤电子对数=![]() =2,水分子氧原子含有2个共价单键,所以价层电子对数是4,价层电子对互斥模型为四面体型,含有2对孤对电子,分子的立体构型为V形,故B正确;
=2,水分子氧原子含有2个共价单键,所以价层电子对数是4,价层电子对互斥模型为四面体型,含有2对孤对电子,分子的立体构型为V形,故B正确;
C.HCHO分子内(H2C=O)碳原子形成3个σ键,无孤对电子,价层电子对互斥模型为平面三角形,没有孤电子对,分子的立体构型为平面三角形,故C错误;
D.二硫化碳分子中碳原子含有2个σ键且不含孤电子对,其空间构型是直线形,故D错误;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】I.能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应 I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应 II:CO(g)+2H2(g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H2____0(填“>”、“<”或“=”)
②若容器容积不变,下列措施可增加甲醇产率的是____
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
E.按原比例再充入CO和H2
③某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO) =0.2mol/L,则CO的转化率为______,此时的温度为___(从上表中选择);
④恒温下,1 molCO和nmolH2在一个容积可变的密闭容器中反应达到平衡后,生成 amolCH3OH。若起始时放入3molCO、3nmolH2,则达平衡时生成CH3OH_______mol。
II.25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)下列四种离子结合质子的能力由大到小的顺序是__________;(填编号)
A.CO32- B.ClO- C.CH3COO- D.HCO3-
(2)下列反应不能发生的是:________
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.CO32-+HClO=CO2↑ +H2O +ClO-
D.2ClO-+CO2
(3)用蒸馏水稀释0.10 mol/L的醋酸,则下列各式表示的数值随水量的增加而增大的是_____;
A.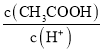 B.
B.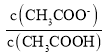 C.
C.![]() D.
D.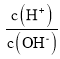
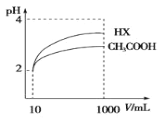
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程 pH 变化如图,则HX的电离平衡常数_______(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的 c(H+)(填“大于”、“等于”或“小于”)
III.以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH_____(填“增大”、“减小”或“不变”),负极反应式为________。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。阳极产生ClO2的反应式为_________。
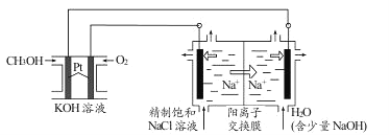
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_________mol。
④在阴极室中加入少量的NaOH的作用是__________。