题目内容
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
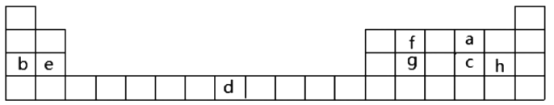
(1)表中字母h元素在周期表中位置___。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型___。
(3)下列事实能说明a元素的非金属性比c元素的非金属性强的有___。
A.a单质与c的氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mola单质比1molc单质得电子数目多
C.a和c两元素的简单氢化物受热分解,前者的分解温度高
(4)g与h两元素的单质反应生成1molg的最高价化合物。恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式___。
(5)常温下d遇浓硫酸形成致密氧化膜,若薄膜为具有磁性的该元素氧化物,写出该反应的化学方程式___。
(6)e与f形成的1mol化合物Q与水反应,生成2mol氢氧化物和1mol烃,该烃分子中碳氢质量比为9∶1,写出烃分子电子式___。
【答案】第三周期、ⅦA族 离子键、(极性)共价键 AC Si(s)+2Cl2(g)=SiCl4(l) H= -687kJ·mol-1 3Fe+4H2SO4(浓)=Fe3O4+4SO2↑+4H2O 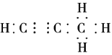
【解析】
由元素周期表可知:a为氧元素、b为钠元素、c为硫元素、d为铁元素、e为镁元素、f为碳元素、g为硅元素、h为氯元素;
(1)表中字母h为氯元素,其在周期表中位置为第三周期、ⅦA族;
(2)b为钠元素,钠的最高价氧化物对应的水化物为NaOH,所含化学键类型为离子键、(极性)共价键;
(3)a为氧元素、c为硫元素;
A.O2与H2S的溶液反应,溶液变浑浊,说明有S生成,即O2的氧化性比S强,即氧元素的非金属性比硫元素的非金属性强,故A正确;
B.元素的非金属性强弱体现得电子能力,与得电子数目无关,故B错误;
C.O和S两元素的简单氢化物受热分解,前者的分解温度高,说明H2O比H2S稳定,即氧元素的非金属性比硫元素的非金属性强,故C正确;
故答案为AC;
(4)已知Si(s)与C12(g)化合反应生成1molSiCl4(l)时放热687kJ,则该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) H= -687kJ·mol-1;
(5)常温下Fe遇浓硫酸形成致密氧化膜,该薄膜为具有磁性说明是Fe3O4,则反应的化学方程式为3Fe+4H2SO4(浓)=Fe3O4+4SO2↑+4H2O;
(6)C与Mg形成的1mol化合物Q与水反应,生成2mol氢氧化物和1mol烃,此氢氧化物应为Mg(OH)2,设化合物Q分子中含有x个C原子,则由原子守恒可知化合物Q的化学式应为Mg2Cx;已知烃分子中碳氢质量比为9:1,其分子中C、H原子数之比=![]() :
:![]() =3:4,结合化合物Q的化学式Mg2Cx,可知该烃分子式为C3H4,C3H4为共价化合物,其电子式为
=3:4,结合化合物Q的化学式Mg2Cx,可知该烃分子式为C3H4,C3H4为共价化合物,其电子式为![]() 。
。