题目内容
【题目】I.能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应 I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应 II:CO(g)+2H2(g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H2____0(填“>”、“<”或“=”)
②若容器容积不变,下列措施可增加甲醇产率的是____
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
E.按原比例再充入CO和H2
③某温度下,将2molCO和6molH2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO) =0.2mol/L,则CO的转化率为______,此时的温度为___(从上表中选择);
④恒温下,1 molCO和nmolH2在一个容积可变的密闭容器中反应达到平衡后,生成 amolCH3OH。若起始时放入3molCO、3nmolH2,则达平衡时生成CH3OH_______mol。
II.25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)下列四种离子结合质子的能力由大到小的顺序是__________;(填编号)
A.CO32- B.ClO- C.CH3COO- D.HCO3-
(2)下列反应不能发生的是:________
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.CO32-+HClO=CO2↑ +H2O +ClO-
D.2ClO-+CO2
(3)用蒸馏水稀释0.10 mol/L的醋酸,则下列各式表示的数值随水量的增加而增大的是_____;
A.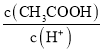 B.
B.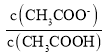 C.
C.![]() D.
D.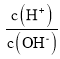
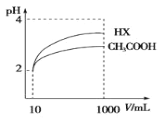
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程 pH 变化如图,则HX的电离平衡常数_______(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的 c(H+)(填“大于”、“等于”或“小于”)
III.以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH_____(填“增大”、“减小”或“不变”),负极反应式为________。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。阳极产生ClO2的反应式为_________。
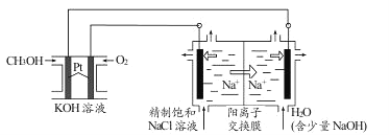
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_________mol。
④在阴极室中加入少量的NaOH的作用是__________。
【答案】< BE 80% 250℃ 3a A>B>D>C CD B 大于 大于 增大 CH3OH-6e-+8OH-=CO32-+6H2O Cl--5e-+2H2O=ClO2+4H+ 1 增强水的导电能力
【解析】
I.(1)①依据平衡常数随温度变化分析,结合平衡移动原理分析热量变化;
②根据影响物质转化率的因素分析判断;
③依据化学平衡的三段式列式计算,依据转化率概念计算判断;
④在恒温和容器的容积可变的密闭容器在发生该反应,物质的平衡转化率不变。
II.(1)酸越弱,其相应的酸根离子结合H+的能力就越强;
(2)强酸可以与弱酸的盐发生反应产生弱酸;
(3)醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,据此分析解答.
(4)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小;
III.①在CH3OH燃料电池中通入甲醇的一极为负极,通入氧气的一极为正极,正极上氧气得电子生成氢氧根离子;
②在电解时Cl-失去电子变为ClO2;
③已知从阴极处收集到的气体比阳极处收集到气体多 6.72L,即x-![]() x=
x=![]() ;通过阳离子交换膜的阳离子为+1价离子,由电子转移守恒计算阳离子的物质的量;
;通过阳离子交换膜的阳离子为+1价离子,由电子转移守恒计算阳离子的物质的量;
④根据电解质溶液在电解质电离产生的离子自由移动,可增强溶液的导电性分析。
(1)①依据表格数据可知:温度升高,化学平衡常数减小,说明升高温度,化学平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热的方向移动。逆反应方向为吸热反应,则该反应的正反应为放热反应,所以△H2<0;
②A.该反应的正反应为放热反应,升高温度,平衡逆向移动,甲醇的产率降低,A不符合题意;
B.将CH3OH(g)从体系中分离,即减小生成物浓度,更多的反应物发生反应转化为甲醇,甲醇的产率增大,B符合题意;
C.使用合适的催化剂对化学平衡移动无影响,因此不能提高甲醇的产率,C不符合题意;
D.充入He,使体系总压强增大,由于任何一种反应体系的物质浓度不变,因此平衡不移动,甲醇的产率不变,D不符合题意;
E.按原比例再充入CO和H2,相当于增大压强,平衡正向移动,可以得到更多的甲醇,甲醇的产率增大,E符合题意;
故合理选项是BE;
③按反应Ⅰ充分反应达到平衡后,测得c(CO)=0.2mol/L,物质的量为0.4mol;
CO(g)+2H2(g)![]() CH3OH(g))
CH3OH(g))
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
CO的转化率=![]() ×100%=80%;
×100%=80%;
此时化学平衡常数K=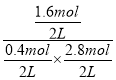 =2.041,可见对应的温度250℃;
=2.041,可见对应的温度250℃;
④在恒温和容器的容积可变的密闭容器在发生反应CO(g)+2H2(g) ![]() CH3OH(g),容器的容积与气体的物质的量呈正比,因此物质的平衡转化率不变,由于加入1 molCO和nmolH2反应达到平衡后,生成amolCH3OH,则若起始时放入3molCO、3nmolH2,则达平衡时生成CH3OH的物质的量为3amol;
CH3OH(g),容器的容积与气体的物质的量呈正比,因此物质的平衡转化率不变,由于加入1 molCO和nmolH2反应达到平衡后,生成amolCH3OH,则若起始时放入3molCO、3nmolH2,则达平衡时生成CH3OH的物质的量为3amol;
II.(1)弱酸的电离平衡常数越大,相应的酸的酸性就越强,其酸根离子结合H+的能力就越弱。根据酸电离平衡常数可知酸性:CH3COOH>H2CO3>HClO>HCO3-,所以结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-,故合理选项是A>B>D>C;
(2)A.由于酸性:CH3COOH>H2CO3,所以可以发生反应CO32-+CH3COOH=CH3COO-+CO2↑+H2O,A不符合题意;
B.由于酸性CH3COOH>HClO,因此可发生反应ClO-+CH3COOH=CH3COO-+HClO,B不符合题意;
C.由于酸性H2CO3>HClO,所以CO32-+HClO=CO2↑ +H2
D.由于酸性H2CO3>HClO>HCO3-,所以不能发生2ClO-+CO2+H2O=CO32-+2HClO反应,D符合题意;
故合理选项是CD;
(3) A.加水稀释醋酸促进醋酸电离,n(H+)增大,n(CH3COOH)减小,所以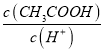 的比值减小,A错误;
的比值减小,A错误;
B.加水稀释醋酸促进醋酸电离,n(CH3COO-)增大,n(CH3COOH)减小,则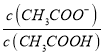 的比值增大,B正确;
的比值增大,B正确;
C.加水稀释促进醋酸电离,但c(CH3COO-) 、c(H+)都减小,但由于温度不变,所以水的离子积常数Kw不变,所以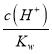 的比值减小,C错误;
的比值减小,C错误;
D.加水稀释醋酸促进醋酸电离,c(H+)减小,温度不变,由于水的离子积常数Kw不变,则溶液中c(OH-)增大,故![]() 的比值减小,D错误;
的比值减小,D错误;
故合理选项是B;
(4)由图可知,两种溶液开始时pH相同,即c(H+)相同,稀释相同的倍数,HX的pH变化程度大,说明酸性HX强,酸的酸性越强,其电离平衡常数大;当酸稀释后,HX电离生成的c(H+)小,对水的电离平衡的抑制能力小,因此HX溶液中水电离出来的c(H+)大;
III.①CH3OH燃料电池中通入甲醇的一极为负极,通入氧气的一极为正极,正极上氧气得电子生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-,溶液中c(OH-)增大,因此通入O2的电极附近溶液的pH增大;通入CH3OH的电极为负极,甲醇失去电子,发生氧化反应,由于溶液为碱性,所以甲醇失去电子后产生的CO2会转化为CO32-,因此负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。在阳极Cl-失去电子,被氧化产生ClO2,根据元素守恒可知由水参加反应,同时生成H+,阳极的电极反应式为Cl--5e-+2H2O=ClO2+4H+;
③已知从阴极处收集到的气体比阳极处收集到气体多 6.72L,假设反应生成的氢气的物质的量为xmol,即x-![]() x=
x=![]() ,解得x=0.5mol;故交换膜的阳离子的物质的量为0.5mol×2=1mol;
,解得x=0.5mol;故交换膜的阳离子的物质的量为0.5mol×2=1mol;
④根据电解质溶液在电解质电离产生的离子自由移动,可增强溶液的导电性可知向在阴极室中加入少量的NaOH的作用是增大附近溶液中离子的浓度,增强溶液的导电能力。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案