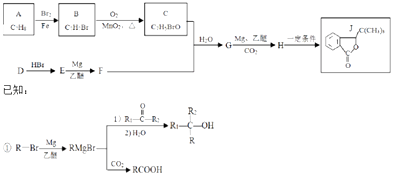
题目内容
【题目】在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
(1)按电子排布,Q元素在周期表中属区.
(2)第一电离能YZ,电负性YZ(填“>”,“=”或“<”).
(3)W与Z形成的常见化合物有W2Z、W2Z2 , W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6…,W2Z分子中Z原子的杂化类型为 , YW3分子的立体构型为 , YW3极易溶于W2Z的主要原因有 .
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 .
(5)Q+与Y3﹣形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏伽德罗常数用NA 表示,则晶体的密度为gcm﹣3 . 
【答案】
(1)ds
(2)>;<
(3)sp3杂化;三角锥形;都是极性分子,相似相溶;NH3与H2O分子间可形成氢键;NH3与H2O发生反应
(4)配位键、极性键
(5)![]()
【解析】解:(1)核外电子排布式为:1s22s22p63s23p63d104s1 , 所以Q元素在周期表中属ds 区,所以答案是:ds;(2)氮核外电子排布处于半满状态,所以第一电离能Y>Z,同周期从左往右电负性增强,所以电负性Y<Z,所以答案是:>;<;(3)H2O分子中O原子的杂化类型为sp3杂化,NH3分子中N原子的杂化类型为sp3杂化,分子的立体构型为三角锥形,氨气与水分子间存在氢键,所以NH3极易溶于H2O,氨气与水反应生成一水合氨,所以答案是:sp3杂化;三角锥形;都是极性分子,相似相溶;NH3与H2O分子间可形成氢键;NH3与H2O发生反应;(4)硫酸铜溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,[Cu(NH3)4]2+中含有的化学键有配位键、极性键,所以答案是:配位键、极性键(5)Cu+与N3﹣形成的晶胞结构如图所示,则晶胞边长为2acm,该晶胞中灰色球个数=8× ![]() =1、黑色球个数=12×
=1、黑色球个数=12× ![]() =3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3﹣相连的Cu+有6个,该晶体的密度=
=3,根据化合价知,灰色球表示氮离子、黑色球表示亚铜离子,与同一个N3﹣相连的Cu+有6个,该晶体的密度= ![]() =
= 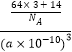 =
= ![]() gcm﹣3 , 所以答案是:
gcm﹣3 , 所以答案是: ![]() .
.