题目内容
(2011?开封一模)“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为
温度(K)
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率
②该反应的正反应为
(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是
a.该条件下此反应的化学平衡常数表达式为K=
b.H2的平均反应速率为0.3mol/(L?s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是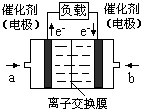 氧气”),b处电极上发生的电极反应是:
氧气”),b处电极上发生的电极反应是:
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于
(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为
C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2kJ/mol
C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2kJ/mol
.温度(K)
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
| CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率
增大
增大
(填“增大”“减小”“不变”).②该反应的正反应为
放
放
(填“吸”或“放”)热反应.(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是
bcd
bcd
.a.该条件下此反应的化学平衡常数表达式为K=
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是
乙醇
乙醇
(填“乙醇”或“ 氧气”),b处电极上发生的电极反应是:
氧气”),b处电极上发生的电极反应是:O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于
2.8×10-5mol/L
2.8×10-5mol/L
.分析:(1)利用盖斯定律可以计算反应的焓变;
(2)增加氢气的量能够使二氧化碳的转化率增大;升高温度化学平衡向着吸热方向进行;
(3)a、化学平衡常数=
(固体和纯溶剂不列入表达式中);
b、化学反应速率等于单位时间内物质的浓度的变化量;
c、物质的转化率=
× 100%,
d、混合气体的密度=
,看分子和分母的变化来判断是否为平衡状态;
(4)失电子的极为负极,燃料电池中燃料作负极,氧气在正极上放电;
(5)根据沉淀的溶度积表达式Ksp=[Ca2+][CO32-]来进行计算.
(2)增加氢气的量能够使二氧化碳的转化率增大;升高温度化学平衡向着吸热方向进行;
(3)a、化学平衡常数=
| 各种生成物浓度系数次方的乘积 |
| 各种反应物浓度系数次方的乘积 |
b、化学反应速率等于单位时间内物质的浓度的变化量;
c、物质的转化率=
| 变化量 |
| 初始量 |
d、混合气体的密度=
| 混合气体的质量 |
| 体积 |
(4)失电子的极为负极,燃料电池中燃料作负极,氧气在正极上放电;
(5)根据沉淀的溶度积表达式Ksp=[Ca2+][CO32-]来进行计算.
解答:解:(1)根据盖斯定律,乙烯水化制乙醇的反应应是2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
和2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol的差,故C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol,故答案为:C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol;
(2)①温度一定时,提高氢碳比[n(H2)/n(CO2)],相当于增加氢气的量,增加氢气的量能够使二氧化碳的转化率增大,故答案为:增大;
②从表中数据看出:温度越高,二氧化碳的转化率越小,升高温度化学平衡向着吸热方向,即向着使二氧化碳的转化率减小的方向(逆向)进行,故正向是放热反应,故答案为:放;
(3)a、化学平衡常数=
(固体和纯溶剂不列入表达式)=K=
,故a正确;
b、H2的平均反应速率=
=0.3mol/(l?min),而不是3mol/(l?s),选项单位错误,故B错误;
c、甲醇的浓度为0.2mol/L,生成的物质的量为0.4mol,则消耗掉的二氧化碳为0.4mol,所以二氧化碳物质的转化率=
× 100%=
×100%=40%,故c错误;
d、混合气体的密度=
,混合气体的质量遵循质量守恒,任何状态下质量均是定值,此反应又是在固定容积为2L的密闭容器中发生,所以体积在任何状态下均是定值,所以密度在任何状态下均是定值,故d错误,故答案为:bcd;
(4)根据乙醇燃料电池的结构示意图可以看出a极为失去电子的极,失电子的极为负极,在燃料电池中燃料作负极,氧气在正极上放电,故答案为:乙醇;O2+4e-+2H2O=4OH-;
(5)根据碳酸钙沉淀的溶度积表达式Ksp=[Ca2+][CO32-],生成沉淀所需Ca2+的最小浓度c=
=
=2.8×10-5mol/L,故答案为:2.8×10-5mol/L.
和2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol的差,故C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol,故答案为:C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ/mol;
(2)①温度一定时,提高氢碳比[n(H2)/n(CO2)],相当于增加氢气的量,增加氢气的量能够使二氧化碳的转化率增大,故答案为:增大;
②从表中数据看出:温度越高,二氧化碳的转化率越小,升高温度化学平衡向着吸热方向,即向着使二氧化碳的转化率减小的方向(逆向)进行,故正向是放热反应,故答案为:放;
(3)a、化学平衡常数=
| 各种生成物浓度系数次方的乘积 |
| 各种反应物浓度系数次方的乘积 |
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
b、H2的平均反应速率=
| △cH2 |
| △t |
c、甲醇的浓度为0.2mol/L,生成的物质的量为0.4mol,则消耗掉的二氧化碳为0.4mol,所以二氧化碳物质的转化率=
| 变化量 |
| 初始量 |
| 0.4mol |
| 1mol |
d、混合气体的密度=
| 混合气体的质量 |
| 体积 |
(4)根据乙醇燃料电池的结构示意图可以看出a极为失去电子的极,失电子的极为负极,在燃料电池中燃料作负极,氧气在正极上放电,故答案为:乙醇;O2+4e-+2H2O=4OH-;
(5)根据碳酸钙沉淀的溶度积表达式Ksp=[Ca2+][CO32-],生成沉淀所需Ca2+的最小浓度c=
| Ksp |
| cCO32- |
| 2.8×10-9 |
| 1.0×10-4 |
点评:本题考查了学生对电化学和化学平衡知识的掌握,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]
