题目内容
 (2011?开封一模)[化学--选修物质结构与性质]
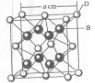
(2011?开封一模)[化学--选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如图.请回答:
(1)A与c形成的共价化合物的分子式是
SiH4
SiH4
,杂化轨道是sp3
sp3
,分子的立体结构是正四面体
正四面体
.(2)B与C比较,电负性较小的是
Si
Si
(填元素符号);B与c形成的化合物晶体类型是分子晶体
分子晶体
. (3)E属元素周期表中第
四
四
周期,第ⅡB
ⅡB
族的元素,其元素名称是锌
锌
,它的+2价离子的电子排布式为1s22s22p63s2sp63d10
1s22s22p63s2sp63d10
.(4)从图中可以看出,D踉B形成的离子化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
分析:B原子的L层p轨道有5个电子,则B原子的电子排布式为1s22s22p5,电子个数为2+2+5=9,所以B为F元素;C是周期表中1-18列中的第14列元素,即为ⅣA族,且C的原子序数大于B,所以C为Si元素;E原子的L层电子数与最外层电子数之比为4:1,L层为8个电子,则E的最外层电子数为8÷4=2,其d轨道中的电子数与最外层电子数之比为5:1,d轨道的电子数为10,电子排布式为1s22s22p63s2sp63d104s2,E为第四周期第ⅡB族的锌元素;D跟B可形成离子化合物,且和E在同一周期,根据晶胞结构可知D为Ca元素,A与其他4种元素既不在同一周期又不在同一主族,且A的原子序数最小,所以A为H元素;根据推断解决问题.
解答:解:B原子的L层p轨道有5个电子,则B原子的电子排布式为1s22s22p5,电子个数为2+2+5=9,所以B为F元素;C是周期表中1-18列中的第14列元素,即为ⅣA族,且C的原子序数大于B,所以C为Si元素;E原子的L层电子数与最外层电子数之比为4:1,L层为8个电子,则E的最外层电子数为8÷4=2,其d轨道中的电子数与最外层电子数之比为5:1,d轨道的电子数为10,电子排布式为1s22s22p63s2sp63d104s2,E为第四周期第ⅡB族的锌元素;根据晶胞结构可看出D跟B可形成离子化合物为面心立方晶格,且D和E在同一周期,所以D为Ca元素;A与其他4种元素既不在同一周期又不在同一主族,且A的原子序数最小,所以A为H元素;
(1)A为H元素,C为Si元素,SiH4分子成键的四个轨道是由一个s轨道和三个p轨道杂化形成,称为sp3杂化,呈正四面体的分子构型;故答案为:SiH4;sp3;正四面体;
(2)电负性用来描述不同元素的原子对键合电子吸引力的大小,B为F元素,C为Si元素,F元素的原子对键合电子的吸引力大,电负性大;F和Si可形成SiF4,常温下为气体,属于分子晶体;故答案为:Si;分子晶体;
(3)E属元素周期表中第四周期第ⅡB族的元素,其元素名称为锌,它的+2价离子的电子排布式为1s22s22p63s2sp63d10;故答案为:四;ⅡB;锌;1s22s22p63s2sp63d10;
(4)D为Ca元素、B为F元素,形成的离子化合物的化学式为CaF2;该晶胞含有Ca2+个数为8×
=4个,根据密度=
,可知该离子化合物晶体的密度=
.
故答案为:
.
(1)A为H元素,C为Si元素,SiH4分子成键的四个轨道是由一个s轨道和三个p轨道杂化形成,称为sp3杂化,呈正四面体的分子构型;故答案为:SiH4;sp3;正四面体;
(2)电负性用来描述不同元素的原子对键合电子吸引力的大小,B为F元素,C为Si元素,F元素的原子对键合电子的吸引力大,电负性大;F和Si可形成SiF4,常温下为气体,属于分子晶体;故答案为:Si;分子晶体;
(3)E属元素周期表中第四周期第ⅡB族的元素,其元素名称为锌,它的+2价离子的电子排布式为1s22s22p63s2sp63d10;故答案为:四;ⅡB;锌;1s22s22p63s2sp63d10;
(4)D为Ca元素、B为F元素,形成的离子化合物的化学式为CaF2;该晶胞含有Ca2+个数为8×
| 1 |
| 2 |
| 质量 |
| 体积 |
| 4×78g/mol |
| a3cm3×6.02×1023mol-1 |
故答案为:
| 4×78g/mol |
| a3cm3?6.02×1023mol-1 |
点评:本题考查原子结构、原子核外电子排布、电负性的含义、晶体类型、晶胞的计算以及原子杂化类型的判断,要充分理解相关知识.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目

