题目内容
(2011?开封一模)已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL 0.01mol/L AgNO3溶液,下列叙述正确是( )
分析:根据溶液中各物质的量计算出剩余c(Cl-),利用溶度积常数计算溶液中离子浓度的比值;
根据溶度积常数大小比较二者的溶解性,溶度积小的先生成沉淀;
根据各物质的量结合反应的程度比较溶液离子浓度的大小.
根据溶度积常数大小比较二者的溶解性,溶度积小的先生成沉淀;
根据各物质的量结合反应的程度比较溶液离子浓度的大小.
解答:解:A、若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,
反应后剩余n(Ag+)=0.003L×0.01mol/L=3×10-5mol,继续生成AgCl沉淀,
反应后剩余n(Cl-)=0.005×0.01mol/L-3×10-5mol=2×10-5mol,c(Cl-)=
=1.53×10-3mol/L,
浊液中C(Ag+)═KSP(AgCl)÷(Cl-)═(1.25×10-5)2÷1.53×10-3═1.02×10-7(mol/L),
C(I-)═KSP(AgI)÷(Ag+)═(1.23×10-8)2÷1.02×10-7═1.48×10-9,
故浊液中Cl-和I-离子浓度之比约为:
=0.507×10-7÷1.48×10-9=0.342×102,故A错误;
B、已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L,
则可知KSP(AgI)<KSP(AgCl),则加入AgNO3溶液时首先生成AgI沉淀,故B错误;
C、混合溶液中n(K+)═1×10-4mol,n(NO3-)=0.008L×0.01mol/L=1×10-5mol,则c(K+)>c(NO3-),根据A项计算可知,c(Cl-)=
=1.53×10-3mol/L,
C(Ag+)═1.02×10-7(mol/L),C(I-)═1.48×10-9,故c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故C正确.
D、反应后c(Cl-)>c(Ag+),故D错误.
故选C.
反应后剩余n(Ag+)=0.003L×0.01mol/L=3×10-5mol,继续生成AgCl沉淀,
反应后剩余n(Cl-)=0.005×0.01mol/L-3×10-5mol=2×10-5mol,c(Cl-)=
| 2×10-5mol |
| 0.013L |
浊液中C(Ag+)═KSP(AgCl)÷(Cl-)═(1.25×10-5)2÷1.53×10-3═1.02×10-7(mol/L),
C(I-)═KSP(AgI)÷(Ag+)═(1.23×10-8)2÷1.02×10-7═1.48×10-9,
故浊液中Cl-和I-离子浓度之比约为:
| c(Cl-) |
| c(I-) |
B、已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L,
则可知KSP(AgI)<KSP(AgCl),则加入AgNO3溶液时首先生成AgI沉淀,故B错误;
C、混合溶液中n(K+)═1×10-4mol,n(NO3-)=0.008L×0.01mol/L=1×10-5mol,则c(K+)>c(NO3-),根据A项计算可知,c(Cl-)=
| 2×10-5mol |
| 0.013L |
C(Ag+)═1.02×10-7(mol/L),C(I-)═1.48×10-9,故c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故C正确.
D、反应后c(Cl-)>c(Ag+),故D错误.
故选C.
点评:本题考查难溶电解制得溶解平衡及溶液中离子浓度大小比较,题目较为复杂,难度较大,本题注意溶液中各物质的量计算出剩余c(Cl-),利用溶度积常数计算溶液中离子浓度的比值.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
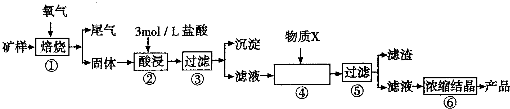

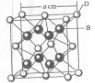 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]